
分析 浓硫酸的质量增加了5.4g,即生成水的质量是5.4g,通过足量澄清石灰水,可得经干燥后的沉淀20g,据此可以计算生成二氧化碳的质量,剩余气体一氧化碳可以和灼热的氧化铁充分反应,生成金属铁和二氧化碳,再通入澄清石灰水时,可根据生成沉淀的质量获得生成二氧化碳的质量,进而求出一氧化碳的质量,根据元素守恒可以计算有机物质的分子式.
解答 解:(1)0.1mol烃的衍生物和0.35mol氧气反应,生成水的质量是5.4g,即生成水的物质的量是0.3mol,所以有机物中H的物质的量为0.6mol,通过足量澄清石灰水,可得干燥后的沉淀20g,根据CO2~CaCO3,所以二氧化碳的物质的量是0.2mol,一氧化碳与灼热的氧化铁充分反应后再通入澄清石灰水时,可得经干燥后的沉淀20g,根据CO~CO2~CaCO3,所以生成一氧化碳的物质的量是0.2mol,则有机物中含C的物质的量是0.4mol,根据氧原子守恒,含有氧原子的物质的量为:0.3mol+0.2mol×2+0.2mol-0.35mol×2=0.2mol,有机物中C、H、O的原子个数比是4:6:2,分子式为:C4H6O2,
答:该有机物的化学式为C4H6O2;
(2)有机物可与醇发生酯化反应,则含有羧基,且可使溴水褪色,含有碳碳双键,所以有机物的结构简式为:
CH2=CH-CH2COOH(1-丁酸);CH3-CH=CHCOOH(2-丁烯酸);CH2=C(CH3)COOH(2-甲基丙烯酸).
答:CH2=CH-CH2COOH(1-丁酸);CH3-CH=CHCOOH(2-丁烯酸);CH2=C(CH3)COOH(2-甲基丙烯酸).
点评 本题考查有机物的确定,题目难度不大,注意从质量守恒的角度计算,把握羧酸的化学性质是关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
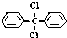 ,对该分子的描述,正确的是( )
,对该分子的描述,正确的是( )| A. | 此分子中存在着6种不同化学环境的氢原子 | |
| B. | 所有碳原子一定都在同一平面上 | |
| C. | 此分子难溶于水 | |
| D. | 此分子属芳香烃类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与甲醇在浓硫酸作用下共热 | B. | 用丙烯与氯化氢反应制氯丙烷 | ||
| C. | 乙醛与银氨溶液共热 | D. | 溴乙烷与NaOH的醇溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
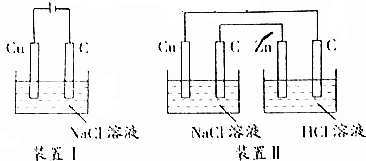
| A. | 装置Ⅰ通电一段时间,可看见溶液变蓝,碳棒上有大量红色物质附着 | |
| B. | 装置Ⅱ能加速铜电极的腐蚀 | |
| C. | 装置Ⅰ将电源换成灵敏电流表,观察到有电流通过 | |
| D. | 装置Ⅰ通电30s后反接电源,再过30s后电极质量未恢复 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | C(HA)mol•L-1 | c(MOH)/mol•L-1 | 混合溶液的pH |
| 甲 | pH=2 | pH=12 | pH<7 |
| 乙 | 0.1 | 0.1 | pH=a |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | a>7 | |
| B. | 在乙组混合液中c(OH-)-c(HA)=10-amol/L | |
| C. | c1<0.2 | |
| D. | 在丁组混合液中c(M+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:6:2 | B. | 9:3:1 | C. | 6:3:2 | D. | 6:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电离方程式可写作H2O2?H++HO2-,HO2-?H++O22- | |
| B. | 加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大 | |
| C. | 加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动 | |
| D. | 加入少量氯化铁溶液,溶液中产生大量气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| B. | 工业上用NO2与水反应制取NO:3NO2+H2O═NO3-+NO+2H+ | |
| C. | 用Cu除去CuCl2溶液中少量的FeCl3杂质:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 向NaAlO2溶液中通入过量CO2制A(OH)3:2AlO2-+CO2+3H2O═2A(OH)3↓+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com