
| A. | NaOH | B. | NaClO | C. | NaCl | D. | Cl2 |
分析 由所发生的反应进行判断,氯气和氢氧化钠反应收获氯化钠和次氯酸钠,次氯酸钠可生成具有强氧化性的HClO,为消毒液的主要成分.
解答 解:溶液中发生的主要的反应为2NaCl+2H2O=2NaOH+H2+Cl2,2NaOH+Cl2=NaCl+NaClO+H2O,则反应后溶液中不存在Cl2、HClO,而NaCl不具有强氧化性,不具有强杀菌消毒能力,NaClO可生成具有强氧化性的HClO,为消毒液的主要成分.该消毒液的有效成分是NaClO,
故选B
点评 本题考查含氯化合物的性质以及用途,为高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可保存在带玻璃塞的玻璃瓶中 | |
| B. | 钠保存在煤油中 | |
| C. | 液氯可以保存钢瓶中 | |
| D. | 过氧化钠、漂白粉要密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强可提高反应速率 | |
| B. | 升高温度可减小反应速率 | |
| C. | 若反应物的总能量比生成物的总能量低,说明该反应是放热反应 | |
| D. | 增大氧气的浓度可使NO2转化率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
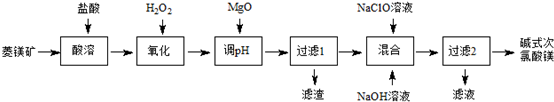
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
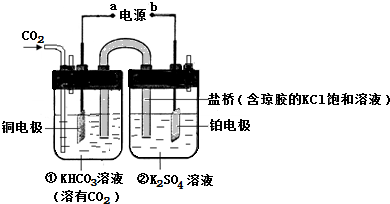
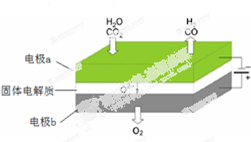
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
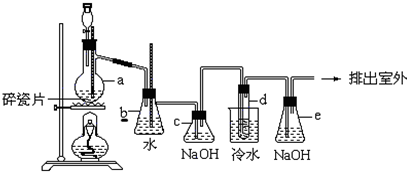
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液:K+、HCO3-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不含其他杂质的天然油脂属于纯净物 | |
| B. | 油脂在酸性条件下水解称为皂化 | |
| C. | 油脂的烃基部分饱和程度越大,熔点越低 | |
| D. | 各种油脂水解后的产物中都有甘油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com