
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH将收制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
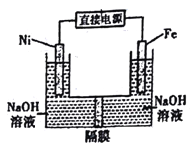
A. 镍是阳极,电极反应为4OH--4e-=O2↑+2H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe→电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高(假设电解前后体积变化忽略不计)
科目:高中化学 来源: 题型:
【题目】根据如图提供的信息,下列所得结论正确的是( ) 
A.该反应过程中,形成新化学键释放的总能量小于断裂旧化学键吸收的总能量
B.因为生成物的总能量低于反应物的总能量,所以该反应不需要加热即可进行
C.该图象可以表示碳酸钙受热分解的能量变化
D.该图象可以表示锌与稀硫酸反应的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(g)+Y(g) ![]() 2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
A. 在10 min时,X的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 无法计算该温度下Y的平衡转化率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨的合成工业的下列说法正确的是( )
A.从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低
B.由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高
C.合成氨工业的反应温度控制在400~500 ℃左右,目的是使平衡向正反应方向进行
D.合成氨工业采用10 MPa~30 MPa,是因该条件下催化剂的活性最好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机化合物A~F的相互转化关系如图,D为石油裂解的主要产物之一,D在标准状况下的密度为1.25 g·L-1,C能发生银镜反应,F为有香味的油状液体。
请回答:
(1)有机物B中含有的官能团名称是________________
(2)D→B的反应类型是______________________
(3)B+E→F的化学方程式是__________________________________________
(4)下列有关说法正确的是______________。
a.在加热条件下,有机物A和C都能使新制的碱性氢氧化铜悬浊液产生砖红色沉定。
b.F在碱性条件下加热水解属于取代反应,又叫皂化反应。
c.D和氧气在一定条件下反应也可以制得C或E。
d.有机物B中是否混有E可用金属钠进行检测。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数K的说法正确的是
A. 已知碳酸: K1=4.4×10-7,K2=4.7×10-11,次氯酸: K1=2.98×10-8,碳酸钠溶液中滴加少量氯水的离子方程式为: CO32-+Cl2+H2O=HCO3-+Cl-+HClO
B. 1.0mol/LNH4HCO3溶液pH=8.0。由此可知Ka1(H2CO3)> Kb(NH3·H2O)>Ka2(H2CO3)
C. 常温下电离常数为Ka 的酸HA溶液中c(H+)= ![]()
D. 将0.1mol/LMgSO4溶液滴入NaOH 溶液中至不再有沉淀产生,再滴加0.1mo/LCuSO4溶液,白色沉淀变为蓝色沉淀,可得出Ksp[Cu(OH)2]sp[Mg(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中的反应:3H2(g)+N2(g)![]() 2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是
2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是
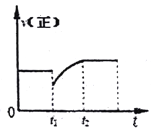
A. 增大NH3浓度的同时减小N2浓度 B. 增大N2和H2的浓度
C. 扩大容器的体积 D. 降低反应温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了进一步提高合成氨的生产效率,科研中具有开发价值的是( )
A.研制高温下活性较大的催化剂
B.寻求NH3的新来源
C.研制低温下活性较大的催化剂
D.研制耐高温高压的新型材料建造合成塔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,被氧化和被还原的原子的物质的量之比是
A. 1:6 B. 5:1 C. 6:1 D. 3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com