
| A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、由C(金刚石)═C(石墨)△H=-1.9kJ/mol 可知,金刚石比石墨稳定 |
| C、在101kpa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |
| D、稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-53.7kJ/mol,若将含0.1mol 醋酸的溶液与含0.1 mol 氢氧化钠的溶液混合,放出的热量小于5.73kJ |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- | ||||
| B、以硫酸铝和小苏打为主要反应物的泡沫灭火器中的反应原理:Al3++3HCO3-═Al(OH)3↓+3CO2↑ | ||||
| C、1 mol/L NH4Al(SO4)2溶液中逐滴加入等体积4 mol/L NaOH溶液:Al3++4OH-═AlO2-+2H2O | ||||
D、用惰性电极电解AlCl3溶液:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+ NO3- Al3+ Cl- |
| B、Na+ CO32- K+ NO3- |
| C、MnO4- K+ SO42- Na+ |
| D、K+ SO42- HCO3- Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠(固体) |
| B、石灰水 |
| C、硫酸钾溶液 |
| D、硫酸铵(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2W-+Z2→2z-+W2 |
| B、2X-+W2→2W-+X2 |
| C、2X-+Y2→2Y-+X2 |
| D、2Z-+X2→2X-+Z2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、反应中的氧化剂只有硫酸铜 |
| B、Cu2S是唯一的还原产物 |
| C、被氧化与被还原硫元素的质量比为7:3 |
| D、若以该反应为原理设计原电池,电池的正极为碳棒,负极是吸附有FeS2粉末的多空石墨电极,电解质溶液为CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为; ③能与水在一定条件下反应生成C ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为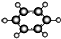 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成 |
| E | ①由C、H、O三种元素组成;②球棍模型为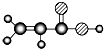 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com