
| A. | 某些金属的单质和化合物在火焰上灼烧时都能显现特殊的颜色,因此焰色反应是元素的性质 | |
| B. | 钾的焰色为紫色,必须通过蓝色钴玻璃才能观察到 | |
| C. | 焰色反应是物理过程,但也可能伴随着化学变化 | |
| D. | 烟花能显现出五颜六色,与烟花中含有某些金属元素的盐类有关 |
分析 A.焰色反应是元素的性质;
B.透过蓝色钴玻璃观察钾元素焰色反应的颜色为紫色;
C.焰色反应是物理变化;
D.不同的金属元素焰色反应颜色不同.
解答 解:A.很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应,根据定义知,无论某元素的单质还是化合物在灼烧时都呈现相同的特殊颜色,所以是元素的性质,故A正确;
B.钾中一般混有钠,黄光能遮盖紫色的光,必须透过蓝色钴玻璃观察钾元素焰色反应的颜色为紫色,故B错误;
C.焰色反应是物理变化,是元素的性质,也可能加热发生化学变化,故C正确;
D.不同的金属元素焰色反应颜色不同,显现出五颜六色,故D正确.
故选B.
点评 本题考查焰色反应,难度不大,注意焰色反应是元素的性质,不是所有的金属都有焰色反应.


科目:高中化学 来源: 题型:解答题
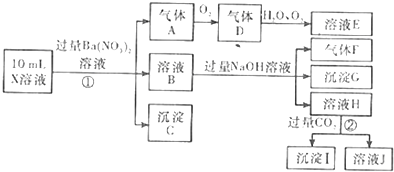
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1 FeCl3溶液中加入0.1 mol•L-1KI溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NO3-、OH-、Cl- | B. | Cu2+、SO42-、H+、Na+ | ||
| C. | H+、Ba2+、Mg2+、NO3- | D. | NH4+、MnO4-、H+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
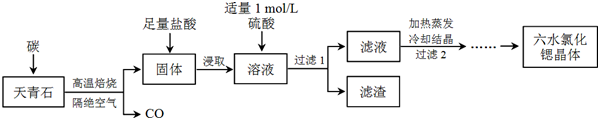
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷的结构简式为CH3CH2CH2CH3 | B. | 一氯乙烷的结构式为CH3Cl | ||
| C. | 四氯化碳的电子式为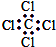 | D. | 苯的分子式为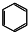 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
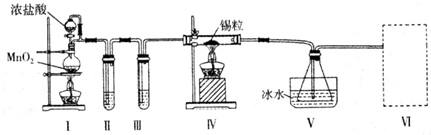
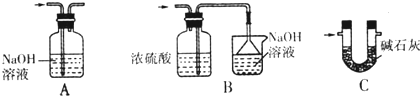
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量:②>①>③ | B. | 氢原子数:②>①>③ | C. | 体积:②>①>③ | D. | 密度:②>③>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com