
| A、以X浓度变化表示的反应速率为0.06mol/(L?min) | ||
B、将容器体积变为20L,Z的平衡浓度为原来的
| ||
| C、平衡时,X的转化率为30% | ||
| D、起始状态和平衡时容器内的气体压强比为2:1 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1.2mol |
| 10L |
| 0.12mol/L |
| 2min |
| 1 |
| 2 |
| 1 |
| 2 |
| 1.2mol |
| 2mol |
| 4mol |
| 2.8mol |
| 10 |
| 7 |


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
 金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.查看答案和解析>>
科目:高中化学 来源: 题型:
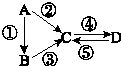 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液中由水电离出的c(H+)=1×10-5mol/L |
| B、c(A-)+c(HA)=2c(Na+)=0.4 mol/L |
| C、c(HA)>c(A-)>c(Na+)>c(H+)>c (OH-) |
| D、c(A-)-c(HA)=2c(H+)-2 c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 | ||||
B、反应A+B
| ||||
| C、相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 | ||||
| D、相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、②③ |
| C、①③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、26.0 kJ |
| B、51.9 kJ |
| C、155.8 kJ |
| D、467.3 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com