
”¾ĢāÄæ”æĪų»ÆŠæŹĒŅ»ÖÖĶøĆ÷»ĘÉ«°ėµ¼Ģ壬Ņ²æÉ×÷ŗģĶā¹āѧ²ÄĮĻ£¬ČŪµć1520”ę”£
£Ø1£©ŠæĄė×ӵĵē×ÓÅŲ¼Ź½ŹĒ_____________”£
£Ø2£©øł¾ŻŌŖĖŲÖÜĘŚĀÉ£¬µēøŗŠŌS______Se£¬µŚŅ»µēĄėÄÜSe______As(Ģī”°>”±»ņ”°<”±£©”£
£Ø3£©H2OµÄ·Šµć______________(Ģī”°>”±»ņ”°<”±£©H2SeµÄ·Šµć£¬ĘäŌŅņŹĒ£ŗ______”£
£Ø4£©NaCl¾§°ūČēĶ¼ĖłŹ¾£¬Ņõ”¢ŃōĄė×Ó¶¼¾ßÓŠĒņŠĶ¶Ō³Ę½į¹¹£¬ĖüĆĒ¶¼æÉŅŌæ“×öøÕŠŌŌ²Ēņ£¬²¢±Ė“Ė”°ĻąĒŠ”±”£¾§°ūÖŠNa£«µÄÅäĪ»ŹżĪŖ____£¬Čō¾§°ū²ĪŹżĪŖa pm£¬°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµÓĆNA±ķŹ¾£¬Čō¾§ĢåĆܶČĪŖ_______g”¤cm©3”£(ĮŠ³ö±ķ“ļŹ½£©”£

£Ø5£©Ķ¾§ĢåÖŠĶŌ×ӵĶѻż·½Ź½ČēĶ¼ĖłŹ¾£¬Ķ¾§ĢåÖŠŌ×ӵĶѻżÄ£ŠĶŹōÓŚ_______”£ČōŅŃÖŖĶµÄŌ×Ó°ė¾¶ĪŖrcm£¬±ķŹ¾Ō×ÓæÕ¼äÕ¼ÓŠĀŹµÄ±ķ“ļŹ½ĪŖ__________”£
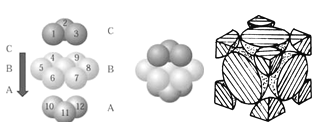
”¾“š°ø”æ1s22s22p63s23p63d10»ņ[Ar]3d10 < > > H2O·Ö×Ó¼ä“ęŌŚĒā¼ü 6 234”Į1030/NA”Įa3 ĆęŠÄĮ¢·½¶Ń»ż ![]()
”¾½āĪö”æ
(1)ZnŹĒ30ŗÅŌŖĖŲ£¬ĘäŌ×ÓŗĖĶāÓŠ30øöµē×Ó£¬Ęä3d”¢4sµē×ÓĪŖĘä¼Ūµē×Ó,Ęä¼Ūµē×ÓÅŲ¼Ź½1s22s22p63s23p63d10»ņ[Ar]3d10£»Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ:1s22s22p63s23p63d10»ņ[Ar]3d10”£
£Ø2£©Ķ¬Ņ»Ö÷×åŌŖĖŲ,ŌŖĖŲµēøŗŠŌĖę×ÅŌ×ÓŠņŹżŌö“ó¶ų¼õŠ”,ĖłŅŌµēøŗŠŌS>Se£»Ķ¬Ņ»ÖÜĘŚŌŖĖŲµŚŅ»µēĄėÄÜĖę×ÅŌ×ÓŠņŹżŌö“ó¶ų³ŹŌö“óĒ÷ŹĘ,µ«µŚIIA×唢µŚVA×åŌŖĖŲµŚŅ»µēĄėÄÜ“óÓŚĘäĻąĮŚŌŖĖŲ,ĖłŅŌµŚŅ»µēĄėÄÜSe<As£»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗ<£¬ >”£
(3) ŗ¬ÓŠĒā¼üµÄĒā»ÆĪļČŪ·Šµć½Ļøß,H2Oŗ¬ÓŠĒā¼ü”¢H2Se²»ŗ¬Ēā¼ü£¬µ¼ÖĀH2OµÄ·Šµć(100”ę)øßÓŚH2SeµÄ·Šµć£Ø-42”ę£©£»Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ: > £»H2O·Ö×Ó¼ä“ęŌŚĒā¼ü”£
(4£©ÓÉNa”¢ClĮ½ŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļĪŖNaCl£¬ŅŌÖŠ¼äµÄŗŚÉ«ĒņĪŖNa+Ąė×ÓŃŠ¾æ£¬ÓėÖ®×ī½üµÄĀČĄė×ÓÓŠ6øö£¬ĖłŅŌ¾§°ūÖŠNa£«µÄÅäĪ»ŹżĪŖ6£»ÕāŠ©ĀČĄė×ÓĪ§³ÉµÄĶ¼ŠĪŹĒÕż°ĖĆęĢ壻¾§°ūÖŠNa+Ąė×ÓŹżÄæ=1+12”Į1/4=4£¬Cl-Ąė×ÓŹżÄæ=8”Į1/8+6”Į1/2=4£¬¹Ź¾§°ūÖŹĮæ=![]() g£¬¾§°ūĢå»ż=[
g£¬¾§°ūĢå»ż=[![]() g”Ā¦Ń]cm3=
g”Ā¦Ń]cm3=![]() cm3£¬Čō¾§°ū²ĪŹżĪŖapm£¬Ģå»żĪŖa3”Į10-30cm3£¬Ōņ
cm3£¬Čō¾§°ū²ĪŹżĪŖapm£¬Ģå»żĪŖa3”Į10-30cm3£¬Ōņ![]() =a3”Į10-30£¬¦Ń=234”Į1030/NA”Įa3 g”¤cm©3£»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗ6£»234”Į1030/NA”Įa3”£
=a3”Į10-30£¬¦Ń=234”Į1030/NA”Įa3 g”¤cm©3£»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗ6£»234”Į1030/NA”Įa3”£
(5£©ÓÉĶ¾§ĢåÖŠĶŌ×ӵĶѻż·½Ź½Ķ¼æÉŅŌÖŖµĄ£¬Ķ¾§ĢåÖŠŌ×ӵĶѻżÄ£ŠĶŹōÓŚĆęŠÄĮ¢·½Ćܶѻż£»ÓÉĶ¾§ĢåÖŠŌ×ӵĶѻż·½Ź½Ķ¼æÉŅŌÖŖµĄ£¬ĶŌ×ÓÅäĪ»ŹżĪŖ3”Į1/2”Į8=12£»ĶŌ×Ó°ė¾¶ĪŖrcm£¬¾§°ū±ß³¤ĪŖ4r”Į![]() /2cm£¬ĆæøöĶ¾§°ūÖŠŗ¬ÓŠ4øöŌ×Ó£¬ŌņĶŌ×ÓµÄĢå»żĪŖ£ŗ4”Į4/3¦Šr3 cm3£¬¾§°ūĢå»żĪŖ£Ø2
/2cm£¬ĆæøöĶ¾§°ūÖŠŗ¬ÓŠ4øöŌ×Ó£¬ŌņĶŌ×ÓµÄĢå»żĪŖ£ŗ4”Į4/3¦Šr3 cm3£¬¾§°ūĢå»żĪŖ£Ø2![]() r£©3£¬¹ŹæÕ¼äĄūÓĆĀŹ£ŗ£Ø4”Į4/3¦Šr3£©/£Ø2
r£©3£¬¹ŹæÕ¼äĄūÓĆĀŹ£ŗ£Ø4”Į4/3¦Šr3£©/£Ø2![]() r£©3=
r£©3= ![]() £»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗĆęŠÄĮ¢·½¶Ń»ż£»
£»×ŪÉĻĖłŹö£¬±¾Ģā“š°øŹĒ£ŗĆęŠÄĮ¢·½¶Ń»ż£» ![]() ”£
ӣ


 ĒįĖÉæĪĢƵ„ŌŖ²āŹŌAB¾ķĻµĮŠ“š°ø
ĒįĖÉæĪĢƵ„ŌŖ²āŹŌAB¾ķĻµĮŠ“š°ø Š”Ģāæń×öĻµĮŠ“š°ø
Š”Ģāæń×öĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°“ŅŖĒóĶź³ÉĻĀæÕ£ŗ
(1)ŅŃÖŖČČ»Æѧ·½³ĢŹ½£ŗSO2(g)£«1/2O2(g)SO3(g)””¦¤H£½£98.32 kJ”¤mol£1£¬ŌŚČŻĘ÷ÖŠ³äČė2 mol SO2ŗĶ1 mol O2£¬³ä·Ö·“Ó¦£¬×īÖշųöµÄČČĮæ______(Ģī×ÖÄø)”£
a.£½196.64 kJ b.£½98.32 kJ c.<196.64 kJ d.>196.64 kJ
(2)FeS2±ŗÉÕ²śÉśµÄSO2æÉÓĆÓŚÖĘĮņĖį”£ĘäÖŠSO2µÄæÕ¼ä½į¹¹ĪŖ________£»H2SO4ÖŠŅõĄė×ÓÖŠŠÄŌ×ÓŌÓ»ÆĄąŠĶĪŖ__________ŌӻƔ£

(3)µŖŹĒµŲĒņÉĻŗ¬Įæ·įø»µÄŅ»ÖÖŌŖĖŲ£¬µŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ”£
¢ŁÉĻĶ¼ŹĒN2(g)ŗĶH2(g)·“Ӧɜ³É1 mol NH3(g)¹ż³ĢÖŠÄÜĮæµÄ±ä»ÆŹ¾ŅāĶ¼£¬ĒėŠ“³öN2ŗĶH2·“Ó¦µÄČČ»Æѧ·½³ĢŹ½____________________________________
¢Ś²¶Ģ¼¼¼Źõ(Ö÷ŅŖÖø²¶»ńCO2)ŌŚ½µµĶĪĀŹŅĘųĢåÅÅ·ÅÖŠ¾ßÓŠÖŲŅŖµÄ×÷ÓĆ”£ÄæĒ°NH3ŗĶ(NH4)2CO3ŅŃ¾±»ÓĆ×÷¹¤Ņµ²¶Ģ¼¼Į£¬ĖüĆĒÓėCO2æÉ·¢ÉśČēĻĀæÉÄę·“Ó¦£ŗ
·“Ó¦¢ń£ŗ2NH3(l)£«H2O(l)£«CO2(g) (NH4)2CO3(aq)”” ¦¤H1
·“Ó¦¢ņ£ŗNH3(l)£«H2O(l)£«CO2(g)NH4HCO3(aq)”” ¦¤H2
·“Ó¦¢ó£ŗ(NH4)2CO3(aq)£«H2O(l)£«CO2(g)2NH4HCO3(aq)””¦¤H3
Ōņa£ŗ¦¤H3Óė¦¤H1”¢¦¤H2Ö®¼äµÄ¹ŲĻµŹĒ¦¤H3£½________”£b£ŗČō·“Ó¦¢ń”¢·“Ó¦¢ņµÄĘ½ŗā³£Źż·Ö±šĪŖK1”¢K2£¬Ōņ·“Ó¦¢óµÄĘ½ŗā³£ŹżK3=__________£ØÓĆK1”¢K2±ķŹ¾£©”£
(4)ŌŖĖŲøõ(Cr)ŌŚČÜŅŗÖŠÖ÷ŅŖŅŌCr3+(Ą¶×ĻÉ«)”¢Cr(OH)4(ĀĢÉ«)”¢Cr2O72(³ČŗģÉ«)”¢CrO42(»ĘÉ«)µČŠĪŹ½“ęŌŚ£¬Cr(OH)3ĪŖÄŃČÜÓŚĖ®µÄ»ŅĄ¶É«¹ĢĢ壬CrO42ŗĶCr2O72ŌŚČÜŅŗÖŠæÉĻą»„×Ŗ»Æ”£
¢ŁĄė×Ó·½³ĢŹ½±ķŹ¾Na2CrO4ČÜŅŗÖŠµÄ×Ŗ»Æ·“Ó¦____________”£
¢ŚČÜŅŗĖįŠŌŌö“ó£¬CrO42µÄĘ½ŗā×Ŗ»ÆĀŹ______(Ģī”°Ōö“ó”°¼õŠ””±»ņ”°²»±ä”±)
¢ŪÉżøßĪĀ¶Č£¬ČÜŅŗÖŠCrO42µÄĘ½ŗā×Ŗ»ÆĀŹ¼õŠ”£¬ŌņøĆ·“Ó¦µÄ¦¤H______0 (Ģī”°“óÓŚ”±”°Š”ÓŚ”±»ņ”°µČÓŚ”±)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚŅŅĻ©ŗĶŅŅĶé±Č½ĻµÄĖµ·ØÖŠ“ķĪóµÄŹĒ£Ø £©
A. ŅŅĻ©ŹōÓŚ²»±„ŗĶĢž£¬ŅŅĶéŹōÓŚ±„ŗĶĢž
B. Ķس£ĒéæöĻĀ£¬ŅŅĻ©µÄ»ÆѧŠŌÖŹ±ČŅŅĶé»īĘĆ
C. ŅŅĻ©ÄÜ·¢Éś¼Ó³É·“Ó¦£¬ŅŅĶéÄÜ·¢ÉśČ”“ś·“Ó¦
D. Ķ¬ÖŹĮæµÄŅŅĻ©ŗĶŅŅĶéĶźČ«Č¼ÉÕ£¬Éś³É¶žŃõ»ÆĢ¼µÄÖŹĮæĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶس£ĖÜĮĻČŻĘ÷µÄµ×²æ¶¼ÓŠŅ»øöŠ”Š”Éķ·ŻÖ¤ ”Ŗ”Ŗ Ņ»øöČż½ĒŠĪµÄ·ūŗÅ£¬Čż½ĒŠĪĄļ±ßÓŠ1~7Źż×Ö£¬Ćæøö±ąŗÅø÷“ś±ķŅ»ÖÖĖÜĮĻ²ÄÖŹ(ČēĻĀĖłŹ¾)”£

(1) 2£6ŗÅĖÜĮĻŹōÓŚ¾ŪĻ©Ģž²ÄÖŹ”£¾ŪĻ©ĢžµÄÉś³É¹ż³ĢÖŠ£¬ŠĪ³ÉĮĖŠĀµÄ___(ĢīŠ“ ”°C£C¼ü”±»ņ”°C£H¼ü”±)£¬·¢ÉśĮĖ_____·“Ó¦(Ģī·“Ó¦ĄąŠĶ)”£
(2) 1ŗÅĖÜĮĻµÄ²ÄÖŹŹĒ¾Ū¶Ō±½¶ž¼×ĖįŅŅ¶ž“¼õ„£¬¼ņ³ĘPET”£½į¹¹¼ņŹ½ČēĶ¼ĖłŹ¾£ŗ

±Č½Ļ1£6ŗÅĖÜĮĻµÄ½į¹¹£¬ĶĘ²āÄÄÖÖ²ÄÖŹøüŅ×æŖ·¢³Éæɽµ½āĖÜĮĻ£¬Ēė½āŹĶŌŅņ_______
PETµÄŗĻ³ÉĀ·ĻßČēĻĀĖłŹ¾:

(3) ÓŠ»śĪļBÖŠ³żĮĖ±½»ł£¬»¹ŗ¬ÓŠµÄ¹ŁÄÜĶÅŹĒ___________”£
(4) ¹¤ŅµÉś²śÖŠ£¬ŅŅĻ©ÖʱøŅŅ¶ž“¼²ÉÓĆŅŅĻ©Ńõ»Æ·Ø(ČēÉĻĶ¼±ķŹ¾)”£Éč¼ĘĮķŅ»ĢõÓÉŅŅĻ©ĪŖŌĮĻÖʵĆŅŅ¶ž“¼µÄŗĻ³É·½°ø£¬Š“³öÕāÖÖ·½·ØĖłÉę¼°µÄ»Æѧ·½³ĢŹ½(ĪŽ»śŹŌ¼ĮČĪŃ”)”£_____
(5) ĶعżĮ½ÖÖĶ¾¾¶µÄ±Č½Ļ£¬½āŹĶ¹¤ŅµÉś²śŃ”ÓĆŅŅĻ©Ńõ»Æ·ØµÄŌŅņ(“ÓŌĮĻ³É±¾”¢»·¾³ĪŪČ¾ŗĶŌ×ÓĄūÓĆĀŹ3øö½Ē¶ČĘĄ¼Ū)”£______
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æīĘµÄ³£¼ū»ÆŗĻ¼ŪĪŖ£«3¼Ū£¬ĪŅ¹śŌĢ²Ų×Å·įø»µÄŗ¬īĘæóŹÆ(Y2FeBe2Si2O10)£¬¹¤ŅµÉĻĶعżČēĻĀÉś²śĮ÷³ĢæÉ»ńµĆŃõ»ÆīĘ”£

ŅŃÖŖ£ŗ¢ŁøĆĮ÷³ĢÖŠÓŠ¹Ų½šŹōĄė×ÓŠĪ³ÉĒāŃõ»ÆĪļ³ĮµķŹ±µÄpH¼ūĻĀ±ķ£ŗ
Ąė×Ó | æŖŹ¼³ĮµķŹ±µÄpH | ĶźČ«³ĮµķŹ±µÄpH |
Fe3£« | 2.1 | 3.1 |
Y3£« | 6.0 | 8.2 |
¢ŚŌŚŌŖĖŲÖÜĘŚ±ķÖŠ£¬īėŌŖĖŲŗĶĀĮŌŖĖŲ“¦ÓŚµŚ¶žÖÜĘŚŗĶµŚČżÖÜĘŚµÄ¶Ō½ĒĻßĪ»ÖĆ£¬»ÆѧŠŌÖŹĻąĖĘ”£
(1)Š“³öNa2SiO3µÄŅ»ÖÖÓĆĶ¾________________________”£
(2)Óū“ÓNa2SiO3ŗĶNa2BeO2»ģŗĻČÜŅŗÖŠÖʵĆBe(OH)2³Įµķ”£
¢Ł ×īŗĆŃ”ÓĆŃĪĖįŗĶ_______Į½ÖÖŹŌ¼Į£¬ŌŁĶعż±ŲŅŖµÄ²Ł×÷¼“æÉŹµĻÖ”£
A£®NaOHČÜŅŗ B£®°±Ė® C£®CO2 D£®HNO3
¢Ś Š“³öNa2BeO2Óė×ćĮæŃĪĖį·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½___________________________”£
(3)³£ĪĀĻĀ£¬·“Ó¦Fe3£«£«3H2O(g) ![]() Fe (OH)3”ż£«3H+µÄĘ½ŗā³£ŹżK= ______”£ĪŖŹ¹Fe3£«³ĮµķĶźČ«£¬ÓĆ°±Ė®µ÷½ŚpH£½aŹ±£¬aÓ¦æŲÖĘŌŚ_________·¶Ī§ÄŚ£»¼ĢŠų¼Ó°±Ė®µ÷½ŚpH =b·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ____________________________”£
Fe (OH)3”ż£«3H+µÄĘ½ŗā³£ŹżK= ______”£ĪŖŹ¹Fe3£«³ĮµķĶźČ«£¬ÓĆ°±Ė®µ÷½ŚpH£½aŹ±£¬aÓ¦æŲÖĘŌŚ_________·¶Ī§ÄŚ£»¼ĢŠų¼Ó°±Ė®µ÷½ŚpH =b·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ____________________________”£
(4)ģŃÉÕ²ŻĖįīĘŹ±·¢Éś·Ö½ā·“Ó¦£¬Ęä¹ĢĢå²śĪļĪŖŃõ»ÆīĘ£¬ĘųĢå²śĪļÄÜŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē”£Š“³ö²ŻĖįīĘ[Y2(C2O4)3”¤nH2O]ģŃÉյĻÆѧ·½³ĢŹ½___________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”¢B”¢C”¢D”¢EŹĒŌŖĖŲÖÜĘŚ±ķĒ°ĖÄÖÜĘŚÖŠµÄ³£¼ūŌŖĖŲ£¬Ō×ÓŠņŹżŅĄ“ĪŌö“ó£¬Ļą¹ŲŠÅĻ¢ČēĻĀ£ŗ
ŌŖĖŲ | Ļą¹ŲŠÅĻ¢ |
A | »łĢ¬Ō×ӵļŪµē×ÓÅŲ¼Ź½ĪŖnSnnPn |
B | ŌŖĖŲŌ×ÓµÄŗĖĶāpµē×ÓŹż±Čsµē×ÓŹżÉŁ1øö |
C | ×īĶā²ćµē×ÓŹżŹĒµē×Ó²ćŹżµÄ3±¶ |
D | ¼ņµ„Ąė×ÓŹĒµŚČżÖÜĘŚŌŖĖŲÖŠĄė×Ó°ė¾¶×īŠ”µÄ |
E | ¼Ūµē×Ó²ćÖŠµÄĪ“³É¶Ōµē×ÓŹżĪŖ4 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öĻĀĮŠŌŖĖŲ·ūŗÅ£ŗA______£¬ B_______£¬C________£¬D__________”£
£Ø2£©Š“³öCŌŖĖŲŌŚÖÜĘŚ±ķµÄĪ»ÖĆ_________£¬E2+¼Ūµē×ӵĹģµĄ±ķŹ¾Ź½______________,BŌŖĖŲÄÜĮæ×īøߵĵē×ÓĪŖ____¹ģµĄÉĻµÄµē×Ó£¬Ęä¹ģµĄ³Ź______ŠĪ”£
£Ø3£©°“Ō×Ó¹ģµĄµÄÖŲµž·½Ź½£¬1molAÓėCŠĪ³ÉµÄ×īøß¼Ū»ÆŗĻĪļÖŠ¦Ņ¼üÓŠ______øö£¬¦Š¼üÓŠ______øö”£(°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµÓĆNA±ķŹ¾)
£Ø4£©B”¢C”¢DµÄ¼ņµ„Ąė×ӵİė¾¶Óɓ󵽊”µÄĖ³ŠņĪŖ________(ÓĆĄė×Ó·ūŗűķŹ¾)”£
£Ø5£©Š“³öCµÄŗĖĶāÓŠ18øöµē×ÓµÄĒā»ÆĪļµÄµē×ÓŹ½_____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚ³£¼ūÓŠ»śĪļµÄĖµ·Ø²»ÕżČ·µÄŹĒ
A.ŅŅĻ©ŗĶ±½¶¼ÄÜÓėäåĖ®·“Ó¦
B.ŅŅĖįŗĶÓĶÖ¬¶¼ÄÜÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦
C.ĢĒĄąŗĶµ°°×ÖŹ¶¼ŹĒČĖĢåÖŲŅŖµÄÓŖŃųĪļÖŹ
D.ŅŅ“¼ŗĶŅŅĖįæÉÓĆĖįŠŌøßĆĢĖį¼ŲČÜŅŗ¼ų±š
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĘū³µĪ²Ęų“¦Ąķ×°ÖĆÖŠ¼ÓČėŹŹµ±µÄ“߻ƼĮ£¬ÄÜ·¢ÉśČēĻĀ·“Ó¦£ŗ4CO£«2NO2![]() 4CO2£«N2”£ĻĀĮŠ¶ŌøĆ·“Ó¦µÄĖµ·ØÖŠ“ķĪóµÄŹĒ
4CO2£«N2”£ĻĀĮŠ¶ŌøĆ·“Ó¦µÄĖµ·ØÖŠ“ķĪóµÄŹĒ
A. øĆ·“Ó¦ŹĒŃõ»Æ»¹Ō·“Ó¦
B. øĆ·“Ó¦ÖŠŃõ»Æ¼ĮŹĒCO”¢»¹Ō¼ĮŹĒNO2
C. øĆ·“Ӧɜ³É28 g N2Ź±£¬×ŖŅĘ8 mol e£
D. øĆ·“Ó¦½«ÄܼõÉŁĘū³µĪ²Ęų¶Ō»·¾³µÄĪŪČ¾
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻÖĘĻõĖįµÄÖ÷ŅŖ·“Ó¦ŹĒ4NH3(g)£«5O2(g)![]() 4NO(g)£«6H2O(g)””¦¤H£½£1025 kJ”¤mol£1
4NO(g)£«6H2O(g)””¦¤H£½£1025 kJ”¤mol£1
£Ø1£©øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK£½________£»ÉżøßĪĀ¶Č£¬KÖµ______(Ģī”°Ōö“ó”±»ņ”°¼õŠ””±»ņ ”°²»±ä”±)£»ÉżøßĪĀ¶Č£¬»Æѧ·“Ó¦ĖŁĀŹ½«______(Ģī”°Ōö“ó”±»ņ”°¼õŠ””± »ņ ”°²»±ä”±)”£
£Ø2£©Čō·“Ó¦ĪļĘšŹ¼µÄĪļÖŹµÄĮæĻąĶ¬£¬ĻĀĮŠ¹ŲĻµĶ¼ÕżČ·µÄŹĒ______(ĢīŠņŗÅ)”£

£Ø3£©Čō“ļµ½Ę½ŗāדĢ¬ŗóÉżøßĪĀ¶ČŌņÕż·“Ó¦ĖŁĀŹŗĶÄę·“Ó¦ĖŁĀŹ___________________ ”££ØĢī”°Ķ¬Ź±Ōö“ó”±»ņ”°Äę·“Ó¦ĖŁĀŹŌö“ó£¬Õż·“Ó¦ĖŁĀŹ²»±ä”±£©
£Ø4£©¹¤ŅµÉĻŗĻ³É°±ĘųµÄ·“Ó¦N2(g)£«3H2(g) ![]() 2NH3(g)¦¤H<0 £¬ŌŚĆܱÕČŻĘ÷ÖŠ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ_______”£
2NH3(g)¦¤H<0 £¬ŌŚĆܱÕČŻĘ÷ÖŠ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ_______”£
¢ŁŃ¹Ēæ²»ŌŁøıä
¢ŚÉś³É°±ĘųµÄĖŁĀŹµČÓŚÉś³ÉµŖĘųµÄĖŁĀŹ
¢ŪÕż·“Ó¦ĖŁĀŹµČÓŚĮć
¢ÜČŻĘ÷ÄŚĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓĮæ²»ŌŁøıä
¢Żµ„Ī»Ź±¼äÄŚÓŠ3amolH-HµÄ¶ĻĮѵÄĶ¬Ź±ÓŠ6amolN-H¶ĻĮŃ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com