
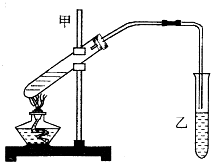
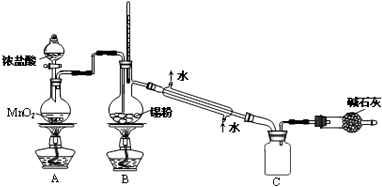
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.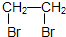 .
. 分析 (1)乙中加饱和碳酸钠溶液可溶解乙醇、反应消耗乙酸,降低乙酸乙酯的溶解度,导管在液面上可防止倒吸;
酯化反应为可逆反应,且浓硫酸具有吸水性;
(2)乙酸与乙醇在浓硫酸作催化剂、加热的条件下发生酯化反应生成乙酸乙酯;
(3)制取乙酸乙酯时,考虑到浓硫酸飞溅,所以先加乙酸,再加入浓硫酸,最后加乙酸;
(4)分离互不相溶的液体用分液;
(5)根据酯化反应为可逆反应,且浓硫酸具有吸水性判断;
(6)加入几块碎瓷片,可防止液体剧烈沸腾;
(7)乙烯使溴水褪色是因为乙烯和溴水中的溴单质发生了加成反应.
解答 解:(1)试管乙中盛放的溶液是饱和碳酸钠溶液,目的是溶解乙醇、反应消耗乙酸,降低乙酸乙酯的溶解度,便于乙酸乙酯的析出;乙中通蒸气的导管不能插入溶液中目的是防止倒吸,
故答案为:饱和碳酸钠溶液;防止倒吸;溶解乙醇、反应消耗乙酸,降低乙酸乙酯的溶解度,便于乙酸乙酯的析出;
(2)乙酸与乙醇在浓硫酸作催化剂、加热的条件下发生酯化反应生成乙酸乙酯,该反应可逆,反应的化学方程式为CH3COOH+CH3CH2OH CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(3)制取乙酸乙酯时,因为向浓硫酸加入溶液容易飞溅,所以先加乙酸,再加入浓硫酸,最后加乙酸,方法为先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最最后再加入乙酸,
故答案为:先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最最后再加入乙酸;
(4)实验完成以后,试管乙的液面上有透明的不溶于水的油状液体乙酸乙酯产生,则分离该物质用分液,需要用到的实验仪器是分液漏斗,故答案为:分液漏斗;
(5)酯化反应为可逆反应,且浓硫酸具有吸水性,则酯化反应中浓硫酸的作用为催化剂、吸水剂,
故答案为:催化剂;吸水剂;
(6)做此实验时,加入几块碎瓷片,其目的是防止暴沸,
故答案为:防止暴沸;
(7)将生成的乙烯通入溴的四氯化碳溶液,乙烯易和溴加成生成1,2-二溴乙烷,即CH2=CH2+Br-Br$\stackrel{四氯化碳}{→}$CH2Br-CH2Br,则反应后生成物的结构简式是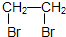 ,故答案为:
,故答案为: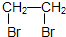 .
.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意有机物的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。对上述事实的分析正确的是
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被氧化
D.亚硝酸盐被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
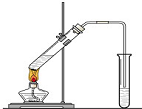 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
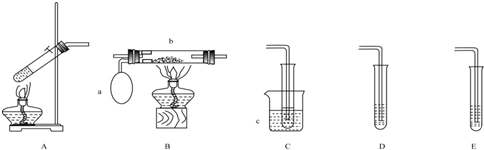
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
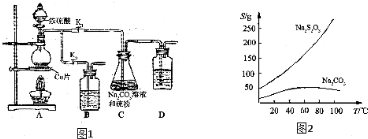
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
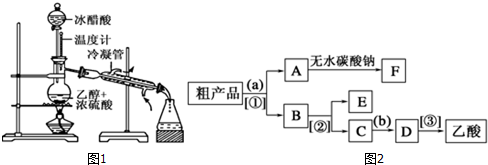
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
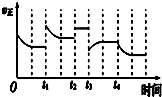 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,在反应过程中,正反应速率的变化如图下列说法正确的是( )
合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,在反应过程中,正反应速率的变化如图下列说法正确的是( )| A. | t1时增大了压强 | B. | t2时充入了稀有气体 | ||
| C. | t3时升高了温度 | D. | t4时降低了温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、NH3、蔗糖分别属于强电解质、弱电解质、非电解质 | |
| B. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 | |
| C. | H2SO3(aq)+2NaOH(aq)=Na2SO3(aq)+2H2O(l)△H>-114.6 kJ/mol | |
| D. | 由石墨比金刚石稳定可推知:C(石墨)═C(金刚石)△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com