
ijЩ�����������������H2O2�ķֽⷴӦ���д����ã���ش��������⣺

��1����֪��2H2O2(aq) = 2 H2O (l)
+ O2(g) �� < 0, ��÷�Ӧ���淴Ӧ�ܷ��Է����У� ����ܡ����ܡ������ж������� ��
< 0, ��÷�Ӧ���淴Ӧ�ܷ��Է����У� ����ܡ����ܡ������ж������� ��
��2��ijͬѧѡ��Ag��Pt��Cu��TiO2��Ϊ��������25�� ʱ����������ʵ��������ͬ��������ɵ�O2�����V����V��ֽ�ʱ��(t)�Ĺ�ϵ��ͼ��ʾ��O2�����������ɱ�״���������ڲ�ͬ���������£�H2O2�ֽⷴӦ�Ļ�ܴ�С˳���� Ea( ) > Ea( ) > Ea( ) > Ea( ) ����������д�����Ļ�ѧʽ)����Pt ���£�H2O2�ֽ�ķ�Ӧ����v(O2) = mol��s-1
��3��Ϊ�о��¶ȶ�H2O2�ֽ����ʵ�Ӱ�죨���Ӵ��������ɽ�һ��Ũ�Ⱥ������H2O2�����ܱ������У���ij�¶��£�����һ����ʱ��t���ⶨ����O2�����V��Ȼ��������ʼ�������䣬�ı��¶�T���ظ�����ʵ�顣���V(O2) ~ T��ϵ���ߡ���������ͼ����ܷ���ʵ��V(O2) ~ T��ϵ���ߵ��� ��ԭ���� ��

(A) (B) (C) (D)
��4����PtΪ�缫���H2O2Ҳ�ɲ���������д��H2O2ˮ��Һ�������еĵ缫��Ӧʽ����֪��H2O2�������Լ���ԭ�Ծ���H2Oǿ�������� ������ ��
��1������ ��1�֣�
�淴Ӧ��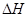 > 0��
> 0��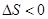 ��������κ��¶��¶������Է����� ��2�֣�
��������κ��¶��¶������Է����� ��2�֣�
��2����Ea(TiO2) > Ea(Cu) > Ea(Pt) > Ea(Ag) ��2�֣�
�� 8.9��10-7 ��2�֣�
��3��C ��2�֣�
��÷�Ӧ�Dz����淴Ӧ���������¶ȶ�ƽ���ƶ���Ӱ�졣�¶����߷�Ӧ���ʼӿ죬���������ͬ��Ӧʱ����õ�O2������¶����߶����� ��2�֣�
��4��H2O2 + 2H+ + 2e- = 2H2O ��2�֣�����������Ҳ���֣�
H2O2 - 2e- = O2�� + 2H+ ��2�֣�����������Ҳ���֣�
��������
���������
��1���÷�Ӧ���淴Ӧ�����ȵķ�Ӧ�����һ����ؼ��ķ�����˲����Է����У��淴Ӧ��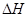 > 0��
> 0��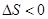 ��������κ��¶��¶������Է�����
��������κ��¶��¶������Է�����
��2���ٴ�ͼ�Ͽ��Կ�������ͬһ��ʱ����ϣ��������ѷֽ����ɵ����������٣�ͭ���������������࣬����У�Ea(TiO2) > Ea(Cu) > Ea(Pt) > Ea(Ag)
�� ��Ӧ�����Ǽ�λʱ����Ũ�ȵı仯����8.9��10-7
��3�������Ӧ���ǿ��淴Ӧ���������Ҫ���������¶ȶ�ƽ���ƶ���Ӱ�졣�¶����߷�Ӧ���ʼӿ죬���������ͬ��Ӧʱ����õ�O2������¶����߶�����
��4��H2O2�������Լ���ԭ�Ծ���H2Oǿ�������������ʧ���Ӷ���˫��ˮ�ˣ�
������H2O2 + 2H+ + 2e- = 2H2O
������H2O2 - 2e- = O2�� + 2H+
���㣺��ѧ��Ӧ���ʡ���ѧ��Ӧ�ķ����Լ��绯ѧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| [CO2]3 |
| [CO]3 |
| [CO2]3 |
| [CO]3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
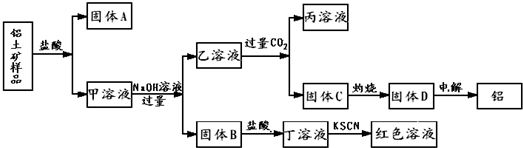
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ĵ�ʡ�ɶ�����2010��2011ѧ���һ��ѧ�����п��Ի�ѧ���� ���ͣ�058
ij�о���ѧϰС���������²�����̽��NH3�Ļ�ԭ�ԣ�����ʵ��װ������ͼ��

��������1��NH3��ǿ��ԭ�����ܽ�ijЩ���������ﻹԭΪ�������ʻ�ͼ�̬���������
��2NH3��3CuO![]() 3Cu��N2��3H2O
3Cu��N2��3H2O
��������2��Cu+��������Һ�в��ȶ����ɷ�������������ԭ��Ӧ����Cu2O(��ɫ)������Cu2+��Cu��
Cu2O
��2H+��ش��������⣺
(1)Ϊ֤��NH3��ԭCuO�ķ�Ӧ����ˮ���ɣ�B��Ӧ������Լ���________��
(2)���۲쵽________(������)��������A�еķ�Ӧ�Ѿ���ɣ�
(3)��С�����������Ϊ1��4��ϡ�������Լ������鷴Ӧ�Ƿ���Cu2O�������ɣ�����98����Ũ��������1��4��ϡ���ᣬ����IJ����������˽�ͷ�ι����________��
(4)��֤����ԭ�����к���Cu2O�IJ�����������________��
(5)��д��A������Cu2O�Ļ�ѧ����ʽ________��
(6)���ö����ķ����ⶨ�÷�Ӧ�Ƿ�����Cu2O��������ȷ�ķ�����________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com