
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。

如果此方案正确,那么:
(1)操作④为________,操作①、④、⑤都用到的玻璃仪器有____________。
(2)操作②为什么不用硝酸钡溶液,其理由是___________________________________。
(3)进行操作②后,如何判断SO42-已除尽,方法是_______________________________。
(4)操作③的目的是____________,为什么不先过滤后加碳酸钠溶液?理由是____________。
(5)操作⑤的目的是____________。
【答案】过滤 烧杯、玻璃棒 溶液中引入新的杂质离子NO3— 取少量上层清液加入BaCl2溶液,若无白色沉淀说明SO42—已除尽 除去过量的Ba2+ 先加Na2CO3然后过滤,可以减少一次过滤操作 除去溶解在溶液中的HCl
【解析】
混合物溶解后加入氯化钡可生成硫酸钡沉淀,过滤后得到滤液含有氯化钠、氯化钡、碳酸氢钠,加入碳酸钠溶液生成碳酸钡沉淀,过滤,滤液中含有碳酸钠、碳酸氢钠和氯化钠,加入盐酸,盐酸和碳酸钠、碳酸氢钠均反应生成氯化钠、水和二氧化碳,加热煮沸,可得到纯净的氯化钠溶液,以此解答该题。
(1)加入碳酸钠后有碳酸钡沉淀产生,除去碳酸钡的方法是过滤,则操作④为过滤;操作①、④、⑤分别是溶解、过滤、蒸发,因此都用到的玻璃仪器有烧杯、玻璃棒。
(2)加入硝酸钡溶液,硝酸钡和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠等新的杂质,因此操作②不用硝酸钡溶液。
(3)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已全部沉淀的判断方法为取少量上层清液加入BaCl2溶液,若无白色沉淀说明SO42—已除尽。
(4)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钡反应生成碳酸钡和氯化钠,目的是除去溶液中过量的Ba2+,先加Na2CO3然后过滤,可以减少一次过滤操作,所以不先过滤后加碳酸钠溶液。
(5)由于盐酸过量,则操作⑤的目的是除去溶解在溶液中的HCl。


科目:高中化学 来源: 题型:
【题目】(1)利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
 △H=+88.62 kJ/mol
△H=+88.62 kJ/mol
以下叙述错误的是________(填序号)
a.NBD的能量比Q的能量高 b.NBD和Q互为同分异构体
c.NBD的分子式为C7H8 d.NBD能使溴水褪色
e. NBD及Q的一氯代物均为三种
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是______。

a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:

①在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
②对锌和稀硫酸反应,实验1和2表明,____对反应速率有影响,实验1和3表明,____对反应速率有影响
③进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。在OA、AB、BC三段中反应速率最快的是_______,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的______、________等物质反应,通常将它保存在_______里。
(3)将一小块钠投入到下列溶液中,既能产生气体又会出现白色沉淀的是________(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。

①列出计算钠相对原子质量的数学表达式______________(用含有a、b、c的算式表示)。
②无水氯化钙的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(gL-1)如图所示。已知盐酸浓度大于1molL-1时,发生反应:PbCl2(s)+2Cl-(aq)═PbCl42-(aq)。下列叙述正确的是
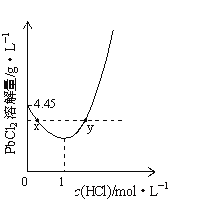
A. 盐酸浓度越小,Ksp(PbCl2)越小
B. x、y两点对应的溶液中c(Pb2+)相等
C. 当盐酸浓度为1molL-1时,溶液中c(Pb2+)一定最小
D. 当盐酸浓度小于1molL-1时,随HCl浓度增大,PbCl2溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应:2SO2(气)+ O2(气)![]() 2SO3(气)。已知反应过程中的某一时刻SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达平衡时,可能存在的数据是
2SO3(气)。已知反应过程中的某一时刻SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达平衡时,可能存在的数据是
A. SO2为0.25 mol·L-1
B. SO2、SO3均为0.15 mol·L-1
C. SO2为0.4 mol·L-1
D. SO2为0.4 mol·L-1,O2为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含有以下种类物质:压缩气体天然气、易燃液体乙酸乙酯、遇湿易燃物品电石、腐蚀品硫化碱等。
回答下列问题:
(1)天然气的主要成分为______(填分子式),试写出它的两种重要用途_________________;
(2)电石的主要成分为CaC2,遇水会剧烈反应生成可燃性气体乙炔(C2H2),CaC2属于_______化合物(填“离子”或“共价”);电石引发的火灾应该可用__扑灭。
A.泡沫灭火器 B.消防车喷水 C.沙土
(3)易燃液体乙酸乙酯是我们比较熟悉的一种化合物,新酿制的酒里含有少量乙醛,所以入口较为生、涩,请用化学反应方程式来表示这一过程_____;
(4)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤。①其水溶液呈强碱性,故俗称硫化碱.原因是(用离子方程式表示)________________;②其水溶液在空气中会缓慢地氧化成硫代硫酸钠(Na2S2O3),写出该反应的化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com