
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是
2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移6mol电子
C. AlN属于离子化合物,其中氮元素的化合价为+3
D. AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
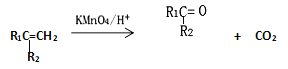
【题目】2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。已知:
![]()
![]()
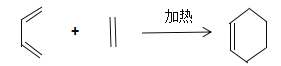

请回答下列问题:
(1)2-甲基-1,3-丁二烯可以与氢气、溴水等发生加成反应。
①完全与氢气加成所得有机产物的名称____________;
②与溴水发生1,2-加成所得有机产物的结构简式为____________ 和 _____________;
③与溴水发生1,4-加成反应的化学方程式为_______________________________________。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式________________________________________。
(3)Y(![]() )是天然橡胶的主要成分。能发生的反应有_________(填标号)。
)是天然橡胶的主要成分。能发生的反应有_________(填标号)。
A.加成反应 B.氧化反应 C.酯化反应
(4)X的分子式为C3H4O3,其结构简式为_________________;X与乙醇发生酯化反应的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工水平的标志,乙烯有如下转化关系。
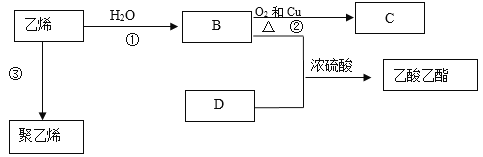
请回答下列问题:
(1)乙烯的结构简式为______。
(2)B所含官能团的名称为____________。
(3)③的反应类型是____________。
(4)浓硫酸的作用是________________。
(5)反应①的化学方程式为________________________________________________。
反应②的化学方程式为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
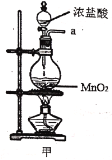
【题目】实验室用干燥而纯净的氯气和二氧化硫合成硫酰氯(SO2Cl2),原理为SO2+Cl2![]() SO2Cl2,装置如图所示(夹持仪器已省略):
SO2Cl2,装置如图所示(夹持仪器已省略):
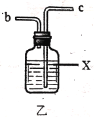
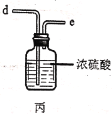
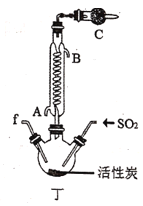
已知有关物质的部分性质如表:
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 不易分解 |
请回答下列问题:
(1)写出甲中制取Cl2的化学方程式___。
(2)利用图中甲、乙、丙装置制取干燥纯净的Cl2,并在丁装置合成硫酰氯,要完成实验目的,按气流从左到右,各接口正确的连接顺序是___。
A.abcdef B.abcedf C.acbdef D.acbedf
乙中试剂X是___。
(3)丁中冷凝管进水口为___(填“A”或“B”)。装置C的作用是___。
(4)硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水晒盐得到的粗盐中还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是实验室制备精盐的实验方案:

(1)除去泥沙和沉淀选用图中___装置,B装置的操作名称是___,在上述方案中图中装置中不会用到的是___。
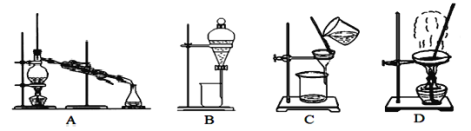
(2)第⑦步操作的名称是___,所用到的实验装置是图中的___(填字母);
(3)为除去粗盐中的可溶性杂质,通常采用以下三种试剂,a:Na2CO3溶液;b:BaCl2溶液;c:NaOH溶液,加入BaCl2试剂的目的是___,三种试剂加入的合理顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A( )是一种重要的化工原料,它的一种合成路线如下图所示:
)是一种重要的化工原料,它的一种合成路线如下图所示:
丙烯![]()
![]()
![]()
![]()
![]()
![]()
![]() 双酚A
双酚A
下列说法正确的是( )
A. 1 mol 双酚A最多可与2 mol Br2反应
B. G物质是乙醛的同系物
C. E物质的名称是1-溴丙烷
D. 反应③的化学方程式是![]() +O2
+O2![]() 2CH3COCH3+2H2O
2CH3COCH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲表示叶绿体的结构,图乙表示暗反应过程。请据图回答下列问题:
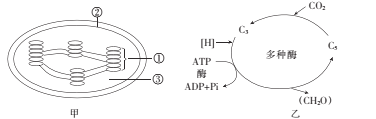
(l)叶绿体中的色素分布于图甲中的____ (填序号);四种色素能在滤纸条上分离,是因为____。
(2)叶绿体进行光合作用时,ATP的移动方向是从____到____(填序号),合成ATP所需的能量来自____。
(3)在光照强度、温度和CO2浓度三种环境因素中,能直接影响图乙所示过程的是 _________。若突然降低光照强度,则在短时间内叶绿体中C3和C5的含量变化分别是 _________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:高温分解FeSO4,利用如图1所示的实验装置进行实验.
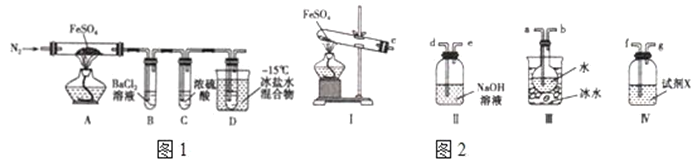
已知:①SO2熔点为﹣72℃,沸点为﹣10℃;
②SO3熔点为﹣16.8℃,沸点为44.8℃。
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是__________________________。
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为______,同时有两种无色气体生成,写出该反应的化学方程式_________________________________。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是___,将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是__________________________。
(4)有人认为该实验装置存在一定的缺陷,再增加一个装置即可弥补该缺陷,请指出添加的仪器位置及药品________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,装置(I)是一种可充电电池,装置(Ⅱ)为惰性电极的电解池。下列说法正确的是

A. 闭合开关K时,电极B为负极,且电极反应式为:2Brˉ-2eˉ=Br2
B. 装置(I)放电时,总反应为:2Na2S2+Br2=Na2S4+2NaBr
C. 装置(I)充电时,Na+从左到右通过阳离子交换膜
D. 该装置电路中有0.1moleˉ通过时,电极Ⅹ上析出3.2gCu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com