
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
分析 (1)易潮解的药品,必须放在玻璃器皿上(如小烧杯、表面皿)里称量;
(2)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,V(标准)用两次的平均值;根据m=c•V•M计算500mL溶液中氢氧化钠的质量,再根据质量分数公式计算氢氧化钠的质量分数;
(4)为便于观察溶液颜色变化,在锥形瓶下垫一张白纸;
(5)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)烧碱易潮解,必须放在玻璃器皿上(如小烧杯、表面皿)里称量,故选A;
(2)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂,故选B;
(3)第一次消耗的标准液的体积为:(20.50-0.40)mL=20.10mL,第二次消耗的标准液体积为:24.00mL-4.10mL=19.90mL,两次滴定数据都是有效的,所以消耗标准液平均体积为20.00mL,
根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.2000mol•{L}^{-1}×0.02L}{0.01L}$=0.4000mol•L-1,
样品中含有烧碱的质量为:m(烧碱)=c•V•M=0.4000mol•L-1×0.5L×40g/mol=8.0g,烧碱的质量分数为:ω=$\frac{8.0g}{8.2g}$×100%=97.56%;
故答案为:0.4000;97.56%;
(4)在盛放待测溶液的锥形瓶下方放一张白纸的作用是观察锥形瓶中溶液颜色的变化明显,减少实验误差;
故答案为:便于观察锥形瓶内液体颜色的变化,减小滴定误差;
(5)①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,待测液的物质的量偏大,造成V(标准)偏高,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏高;
故答案为:偏高;
②若锥形瓶未干燥就加入10.00mL待测液,V(标准)无影响,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)无影响,故答案为:无影响.
点评 本题主要考查了酸碱中和滴定的操作以及有关的化学计算,难度中等,掌握中和滴定的原理是解题的关键.


科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:填空题
镍(28Ni)金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为_____________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:__________、_____________、___________。

(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示.则该晶体的化学式为_________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式__________。
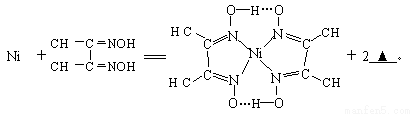
与Ni2+配位的N原子有_________个,该配合物中存在的化学键有__________(填序号)。
A共价键 B离子键 C配位键 D金属键 E氢键
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
镁铝合金5.1 g溶于300 mL 2 mol·L-1的盐酸中,在标准状况下放出气体的体积为5.6 L。向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
A.5.1 g B.10.2 g C.13.6 g D.15.3 g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:填空题
工业上常用FeCl3溶液制印刷电路板并再生,主要过程如下:
腐蚀Cu:2FeCl3+Cu=CuCl2+2FeC12;
然后回收Cu:Fe+CuCl2=Cu+FeCl2;
再生FeC13:2FeC12+C12=2FeC13。
将某电路板上的Cu腐蚀完全,恰好消耗0.5L2mol/LFeCl3。全过程忽略体积的变化。
回答下列问题:
(1)画出Cl原子结构示意图:________________;
(2)将Cu腐蚀一半时,溶液中的金属阳离子有:_______________;此时c(Cl-)为:____________mol/L;
(3)腐蚀的Cu的总物质的量为:______________mol;
(4)再生FeC13时,溶液由___________色最终变为___________色;消耗的Cl2在标准状况下的体积至少为:________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2-3次 | |
| B. | 可使用酚酞或甲基橙作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准溶液的刻度时,滴定前平视,滴定后仰视,测定结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
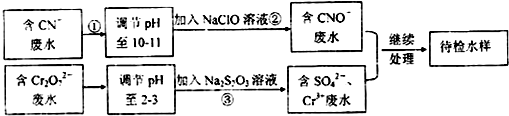
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com