
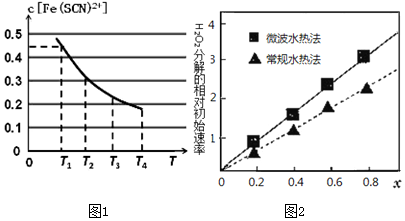
分析 (1)溶液存在平衡:Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq),忽略其他过程,根据图1,温度升高,溶液中c[Fe(SCN)2+]下降,可知温度升高,平衡向逆反应方向移动,温度为T1时,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45mol/L,根据化学反应平均速率公式计算$\overline{r}[Fe(SCN)^{2+}]=\frac{△c}{△t}$,由化学反应速率之比等于化学计量数之比计算平均反应速率v(SCN-),该温度下的Fe3+的平衡转化率为转化的Fe3+的量与初始量比值的百分数,将溶液中各组分的平衡浓度代入平衡常数表达式计算化学平衡常数;
(2)草酸钴(CoC2O4)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,反应为Co2+与C2O42-反应形成草酸钴,据此写出反应的离子方程式;
(3)某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,向其中滴加NaOH溶液,根据溶度积常数计算;
(4)比较催化剂的活性对H2O2分解的影响,采用控制变量法并结合图2分析.
解答 解:(1)溶液存在平衡:Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq),忽略其他过程,根据图1,温度升高,溶液中c[Fe(SCN)2+]下降,可知温度升高,平衡向逆反应方向移动,则表明正反应是放热反应,则该反应△H<0,
温度为T1时,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45mol/L,反应经历的时间△t=5s,则$\overline{r}[Fe(SCN)^{2+}]=\frac{△c}{△t}$=$\frac{0.45mol/L}{5s}$=0.09mol/(L•s),由化学反应速率之比等于化学计量数之比,则达到平衡时的平均反应速率v(SCN-)=0.09mol/(L•s),
根据反应方程式计算,平衡时c(Fe3+)=$\frac{0.5mol}{1L}-0.45mol/L$=0.05mol/L,c(SCN-)=$\frac{0.5mol}{1L}-0.45mol/L$=0.05mol/L,则该温度下的Fe3+的平衡转化率为$α=\frac{0.45mol/L}{0.5mol/L}×100%$=90%,
该温度下的平衡常数为K=$\frac{c[Fe(SCN)^{2+}]}{c(F{e}^{3+})c(SC{N}^{-})}$=$\frac{0.45mol/L}{0.05mol/L×0.05mol/L}$=180L/mol,
故答案为:<;0.09;90%;180L/mol;
(2)草酸钴(CoC2O4)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,反应为Co2+与C2O42-反应形成草酸钴,则该反应的离子方程式为:C2O42-+Co2+=CoC2O4↓,
故答案为:C2O42-+Co2+=CoC2O4↓;
(3)某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,已知Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15,当Co(OH)2开始沉淀时,溶液中$\frac{c(C{o}^{2+})}{c(N{i}^{2+})}$=$\frac{c(C{o}^{2+})}{c(N{i}^{2+})}•\frac{{c}^{2}(O{H}^{-})}{{c}^{2}(O{H}^{-})}$=$\frac{{K}_{sp}[Co(OH)_{2}]}{{K}_{sp}[Ni(OH)_{2}]}$=$\frac{6.0×1{0}^{-15}}{2.0×1{0}^{-15}}$=3.0,注意保留两位有效数字,
故答案为:3.0;
(4)比较催化剂的活性对H2O2分解的影响,采用控制变量法分析,取x不变时来看,微波水热法时对应的H2O2的分解速率高于常规水热法时的分解速率,则微波水热法制取得到的催化剂活性更高,
控制水热法相同,随着x的增加,即Co增加,Ni减小,根据图象分析,H2O2的分解速率随x的增大而增大,表明Co2+对分解有促进作用,因此Co2+、Ni2+两种离子中催化效果较好的是Co2+,
故答案为:微波水热;Co2+.
点评 本题主要考查化学原理部分知识,包含化学反应速率的计算,化学平衡常数的计算,离子反应的书写,溶度积常数的计算,均为高频考点,平时需注意这方面知识的训练,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol苯分子中含有C=C双键数目为3NA | |
| B. | 标准状况下,11.2 L CCl4中含有的共价键数目为2NA | |
| C. | 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA | |
| D. | 常温常压下,17 g 羟基含有的电子总数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮气的结构式N≡N;
氮气的结构式N≡N;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和硝酸反应 | B. | H2S与氧气反应 | ||
| C. | 碳酸钠溶液和盐酸反应 | D. | 硫在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在晶体中只要有阳离子就一定有阴离子 | |
| B. | CaTiO3晶体(如图)中每个Ti4+和12个O2-相紧邻CaTiO3的晶体结构模型(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点) | |
| C. | 金属晶体中金属离子电荷数越多,离子半径越小,金属键就越弱 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 在上述结构示意图中,所有氧原子都采用sp3 杂化 | |
| B. | 在上述结构示意图中,存在配位键、共价键和离子键 | |
| C. | 胆矾是分子晶体,分子间存在氢键 | |
| D. | 胆矾中的水在不同温度下会分步失去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 篮烷的分子式为C12H14 | |
| B. | 篮烷分子中存在2个六元环 | |
| C. | 篮烷分子中存在2个五元环 | |
| D. | 篮烷的一氯代物共有4种同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com