
【题目】某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。任务1:利用如图所示装置探究NO2能否被NH3还原(夹持固定装置已略去)。
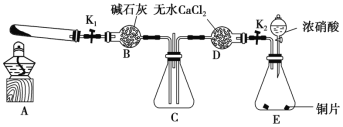
请回答下列问题:
(1)E装置中制取NO2的化学方程式是_____________________________。
(2)此实验装置存在的一个明显缺陷是_______________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(3)实验前,该小组同学提出三种假设。
假设1:二者不反应;假设2:NO2能被Na2O2氧化;
假设3:________________________________________________。
(4)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。

①装置的合理连接顺序是(某些装置可以重复使用)_________________。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为______________________。
【答案】Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 缺少尾气吸收装置 NO2能被Na2O2还原 EDBDF 2NO2+Na2O2=2NaNO3
【解析】
浓硝酸和铜反应生成硝酸铜、二氧化氮和水;若NO2能够被NH3还原,则混合气体的颜色将变浅;A装置用于制备NH3,NH3被碱石灰干燥后进入C装置,E装置生成的NO2经无水CaCl2干燥后也进入C装置,由于NO2具有氧化性,NH3具有还原性,故在C装置中发生反应,随着红棕色的NO2被消耗,C装置中气体的颜色逐渐变浅;所以若NO2能够被NH3还原,预期观察到C装置中的现象是C装置中混合气体颜色变浅,据此分析。
(1)E装置中浓硝酸与铜片发生反应生成NO2,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)由于多余的NH3、NO2会从C装置中竖直的玻璃导管中逸出,污染环境,所以缺陷是缺少尾气吸收装置;
(3)根据价态分析,NO2中氮元素处于中间价态,既有氧化性又有还原性,Na2O2中的氧元素也处于中间价态,既有氧化性又有还原性,所以假设3应是NO2能被Na2O2还原;
(4)①选择E装置制备NO2,选择D装置干燥NO2,选择B装置盛放Na2O2,选择F装置进行尾气处理,为防止F装置中蒸发出的少量水蒸气对B装置中的反应产生干扰,最好在B、F装置间再加D装置,故装置连接顺序为EDBDF;
②假设2是NO2能被Na2O2氧化,根据B装置产生的实验现象“淡黄色粉末逐渐变成白色”可知Na2O2与NO2发生了反应,NO2为还原剂,分子中氮元素的化合价升高到+5价,反应产物又只有一种,因此推知发生的反应为2NO2+Na2O2=2NaNO3。


 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语表示或描述不正确的是
A. Ca的电子排布式是[Ar]3d2
B. BF3 的VSEPR的模型名称是平面三角形
C. NH4+中心原子N上的孤电子对数为0
D. 在[Cu(NH3)4]2+里,NH3的氮原子给出孤电子对,形成配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是无色具有水果香味的液体,沸点为77.2 ℃,实验室某次制取乙酸乙酯用醋酸14.3 mL、95%乙醇23 mL,还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合的氯化钙溶液。主要装置如图所示:
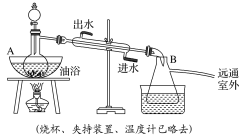
实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温约135~145 ℃。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是_____。
(2)用饱和Na2CO3溶液洗涤粗酯的目的是______。如果用NaOH溶液代替Na2CO3溶液将引起的后果是____。
(3)用饱和CaCl2溶液洗涤粗酯的目的是_____。
(4)在步骤⑧所得的粗酯里还含有的杂质是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜片(含少量杂质铁)为原料制取Cu(NO3)2溶液的实验流程如图:

(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:___。
(2)“水洗”后检验铜片表面是否洗涤干净的方法是___。
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O

①“酸溶”时为防止反应过于剧烈,可以采取的方法有___和___。
②通入空气的作用是___、___。
(4)“调节pH=3~4,并保温3个小时”的目的是___。
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:___。
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为_______,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为________________。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(夹持装置未画出)。
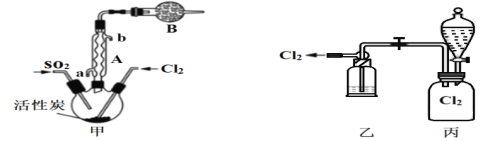
①仪器A的名称为___________,装置乙中装入的试剂_____________,装置B的作用是_______________________。
②装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水 B.10.0 mol/L浓盐酸
C.浓氢氧化钠溶液 D.饱和食盐水
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。
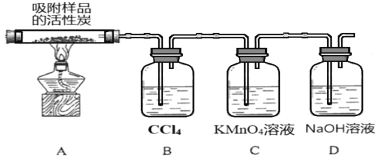
①加热时A中试管出现黄绿色,装置B的作用是 ____________。
②装置C中的现象是___________,反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
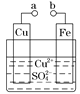
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会溶解
D.a和b用导线连接后,Fe片作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃通过催化加氢后得到2-甲基丁烷,该烃不可能是( )
A. 3-甲基-1-丁炔B. 2-甲基-1-丁炔
C. 3-甲基-1-丁烯D. 2-甲基-1-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上可通过下列反应制备:
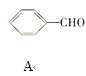 +CH3CHO
+CH3CHO![]()
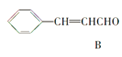 +H2O
+H2O
下列相关叙述正确的是( )
①B的相对分子质量比A大28;②A、B可用酸性高锰酸钾溶液鉴别;③B中含有的含氧官能团是醛基、碳碳双键;④A、B都能发生加成反应、还原反应;⑤A能发生银镜反应; ⑥B的同类同分异构体(含苯环、不包括B)共有4种;⑦A中所有原子一定处于同一平面。
A. 只有①②⑤B. 只有③④⑤C. 只有④⑤⑥D. 只有②⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
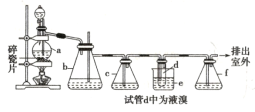
有关数据列表如下:
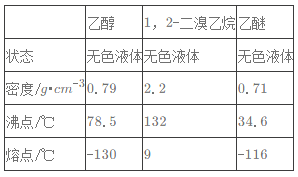
回答下列问题:
(1)在装置c中应加入_______(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备1,2-二溴乙烷反应已结束的最简单方法是_________。
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用_______(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过(①)反应制得(②),②通过(③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①__________________(填反应类型)
②__________________(填该物质的电子式)
③__________________(填反应类型)
写出第一步的化学方程式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com