
【题目】有一含 Na2CO3·xH2O和 NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 CO2 和 H2O的质量,来确定 Na2CO3··xH2O中 x的数值。
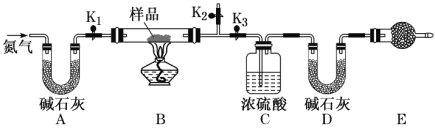
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,检查装置的气密性。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶 C 的质量和盛装碱石灰的 U形管 的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入氮气数分钟,其目的是_________________________。
④关闭活塞K1、K2,打开 K3,点燃酒精灯,加热至不再产生气体。加热时 NaHCO3 发生反应的化学方程式为___________________________________。
⑤打开活塞 K1,缓缓鼓入氮气数分钟,然后拆下装置,再次称量洗气瓶C的质量和 U形管 D的质量。
(2)关于该实验方案,请回答下列问题。
①装置 E的名称是_________,E中盛放的试剂也是碱石灰,其作用是_______________________________。
②若样品质量为 29.3 g,反应后 C、D 装置增加的质量分别为 9 g、4.4 g,则 Na2CO3·xH2O中x为___________。
【答案】除去装置中的水蒸气和二氧化碳 2NaHCO3= Na2CO3+CO2↑+H2O 干燥管(或球形干燥管) 防止空气中的CO2和水蒸气进入D中影响测定结果 x=8
【解析】
根据实验装置及目的可确定,A为吸收氮气中的水蒸气,B为碳酸氢钠及碳酸钠晶体受热分解的装置,C为吸收产生的水蒸气,D为吸收碳酸氢钠分解产生的二氧化碳气体,E为防止空气中的水蒸气、二氧化碳进入装置D,导致测定结果错误,通入氮气为使装置B中产生的水蒸气及二氧化碳均被完全吸收。
(1)③打开活塞K1、K2,关闭K3,缓缓鼓入氮气数分钟,可除去装置中的水蒸气和二氧化碳,使整个装置充满氮气;
④加热时 NaHCO3受热分解生成碳酸钠、二氧化碳和水,化学方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(2)①装置E为球形干燥管;E的目的为防止空气中的CO2和水蒸气进入D中影响测定结果,可盛有碱石灰;
②C、D 装置增加的质量分别为 9 g、4.4 g,则生成的水的物质的量为0.5mol,二氧化碳为0.1mol,只有碳酸氢钠生成二氧化碳,则n(NaHCO3)=0.2mol,其质量为16.8g,m(Na2CO3·xH2O)=29.3-16.8=12.5g,其含有水蒸气的物质的量=0.5-0.1=0.4mol,则碳酸钠的质量=12.5-0.4×18=5.3g,即0.05mol,n(Na2CO3):n(H2O)=0.05:0.4=1:8,则x=8。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】现有Fe和Fe2O3组成的混合物27.2g,与100mL一定浓度稀硫酸恰好完全反应,放出标准状况下2.24L H2,向反应后的溶液中滴入KSCN溶液,未见红色。求混合物中Fe的质量____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂电池的总反应式为:2Li+FeS=Fe+Li2S[LiPF6SO(CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H24.48L。下列有关叙述不正确的是
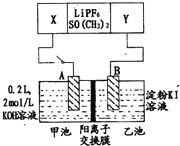
A.从隔膜中通过的离子数目为0.4NA
B.若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4mol/L
C.A电极为阳极
D.电源正极反应式为:FeS+2Li++2e-=Fe+Li2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiOH是制备锂离子电池的材料,可由电解法制备。工业上利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法正确的是
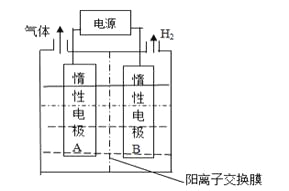
A.B极区电解液为LiOH溶液
B.电极每产生22.4L气体,电路中转移2mole-
C.电解过程中Li+迁移入B电极区、OH-迁移入A电极区
D.电解池中总反应方程式为:2HCl![]() 2H2↑+Cl2↑
2H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校实验室从化学试剂商店买回的盐酸试剂上的标签如图所示。下列说法正确的是

A.从试剂瓶中取出100 mL该盐酸,在空气中久置,溶液质量将增大
B.1 mol Fe与足量该酸反应产生22.4 L氢气
C.配制250 mL 6 mol · L-1稀盐酸需取该浓盐酸100 mL
D.该溶液溶质的物质的量浓度约为12 mol · L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.将氯气溶于水获得新制氯水:Cl2+H2O=2H++Cl-+ClO-
B.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+
C.过量CO2通入NaAlO2溶液中制备氢氧化铝:AlO2-+CO2+2H2O=Al(OH)3↓+CO32-
D.向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作中发生“先产生沉淀,然后沉淀又溶解”现象的是
①向澄清石灰水中逐渐通入CO2至过量 ②向NaAlO2溶液中逐渐通入CO2至过量
③向AlCl3溶液中逐滴加入NaOH至过量 ④向硅酸钠溶液中逐滴加入盐酸至过量
⑤向Fe(OH)3胶体中逐滴加入稀盐酸至过量 ⑥向Ca(ClO)2溶液中逐渐通入CO2至过量
A.①③B.①②⑤C.①③⑤⑥D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年为门捷列夫发现元素周期律150周年。门捷列夫预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2)制取高纯度锗,其工艺流程如图所示。请回答:
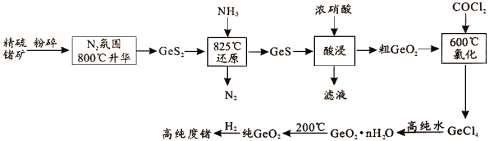
(1)锗在元素周期表中的位置是__________。
(2)800℃,在N2氛围中使精硫锗矿升华的目的是______________。
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式____。酸浸时温度不能过高的原因是_____
(4)GeCl4易水解生成GeO2·nH2O,此过程化学方程式为_____。温度对GeCl4水解率的影响如图所示,为提高水解率,实验时可采取的措施为______(填序号)。

A.冰水浴
B.冰盐水浴
C.49℃水浴
(5)请判断25℃时0.1mol·L-1NaHGeO3溶液pH________(填“>”=”或“<”)7,理由是____(已知25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述中正确的是
A. 6.02×1022个H2SO分子在水中可电离生成2NA个H+
B. 在0℃、101kPa时,22.4L氢气中含有NA个氢原子
C. 14g氮气中含有7NA个电子
D. NA个一氧化碳分子和0.5mol甲烷的质量比为7︰4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com