
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A | CuSO4 | FeSO4 | 加入过量铁粉,过滤 |
| B | NaNO3 | CaCO3 | 溶解、过滤 |
| C | CO2 | O2 | 通入NaOH溶液,洗气 |
| D | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Fe与硫酸铜反应;
B.碳酸钙不溶于水,硝酸钠溶于水;
C.NaOH与二氧化碳反应;
D.硝酸银与NaCl反应生成沉淀和NaCl.
解答 解:A.Fe与硫酸铜反应,将原物质除去,不能除杂,故A;
B.碳酸钙不溶于水,硝酸钠溶于水,则溶解、过滤可除杂,故B正确;
C.NaOH与二氧化碳反应,将原物质除去,不能除杂,故C错误;
D.硝酸银与NaCl反应生成沉淀和硝酸钠,引入新杂质钠离子,应选试剂为KCl,故D错误;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意除杂的原则及元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
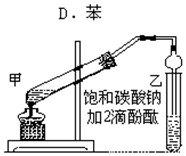 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: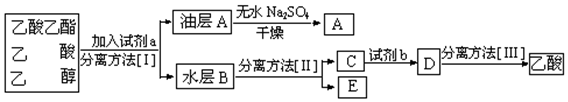
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 产物不稳定,受热即脱水而生成不饱和醛.
产物不稳定,受热即脱水而生成不饱和醛.
 ;F
;F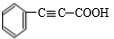 .
. +CH3CHO$\stackrel{△}{→}$
+CH3CHO$\stackrel{△}{→}$ +H2OE→F
+H2OE→F +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$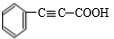 +2NaBr+2H2O
+2NaBr+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
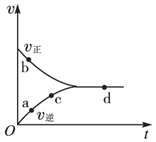 一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )
一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl固体中混有少量的I2,可用加热的方法将I2除去 | |
| B. | 少量浓硝酸保存在无色细口瓶中 | |
| C. | 用浓硫酸吸收二氧化硫中混有少量SO3气体 | |
| D. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
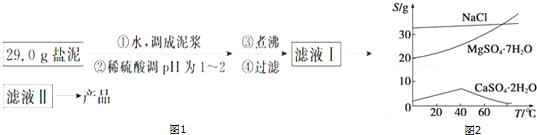
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com