
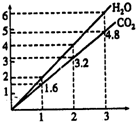
 两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )| A. | 一定含有CH4 | B. | 一定含有C2H6 | C. | 一定含有C2H4 | D. | 一定不含有C3H4 |
分析 由图可知,1体积混合气体完全燃烧生成1.6体积二氧化碳气体和2体积水,则两种气态烃的平均组成为C1.6H4,根据碳原子平均数可知,混合气体一定含有CH4,由氢原子平均数可知,另一气态烃中氢原子数目为4,碳原子数目大于1.6,不超过4,据此判断.
解答 解:由图可知两种气态烃的平均组成为C1.6H4,根据碳原子平均数可知,混合气体一定含有CH4,由氢原子平均数可知,另一气态烃中氢原子数目为4,碳原子数目大于1.6,不超过4,可能含有C2H4、C3H4,
A.两种气态烃的平均组成为C1.6H4,根据碳原子平均数可知,混合气体一定含有CH4,故A正确;
B.C2H6中氢原子数目为6,氢原子数目大于4,所有不可能含有C2H6,故B错误;
C.可能含有C2H4、C3H4,则不一定含有C2H4,故C错误;
D.含有可能含有C2H4、C3H4,故D错误;
故选A.
点评 本题考查烃混合物分子式确定,题目难度中等,利用图象数据正确推断该混合烃的平均分子式为解答关键,注意掌握平均分子式中确定有机物分子组成中的应用方法.


科目:高中化学 来源: 题型:解答题
 ,C02的结构式为O=C=O.
,C02的结构式为O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Kw变大、pH变小、呈酸性 | B. | Kw变大、pH不变、呈中性 | ||
| C. | Kw变小、pH变大、呈碱性 | D. | Kw变大、pH变小、呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者大 | B. | 前者小 | C. | 相等 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL | B. | 500 mL | C. | 1000 mL | D. | 1500 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 生石灰与水混合的过程只发生物理变化 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤Ⅰ | 称取NaClO2样品Wg,加水配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol•L-1的 Na2S2O3溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1 mol/L HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中,Ksp(CaF2)=$\frac{1}{{K}_{a}HF}$ | |
| D. | 该体系中有CaF2沉淀产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com