
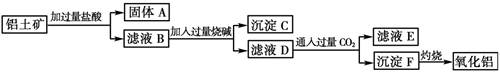


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源:不详 题型:单选题
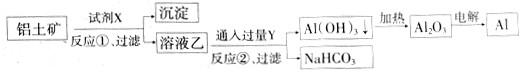
| A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
| B.反应①、过滤后所得沉淀为Fe2O3 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.试剂X可以是氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
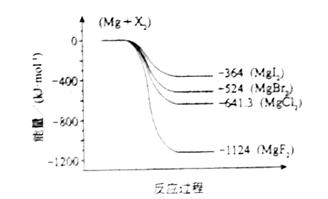
 HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7  CO32- + H+ Ka2(H2CO3) = 5.61×10-11
CO32- + H+ Ka2(H2CO3) = 5.61×10-11 H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,铝和浓硫酸、浓硝酸不反应。 |
| B.两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应生成的氢气前者多。 |
| C.合金的熔点一般比组成的金属成分的熔点都低 |
| D.用酒精灯加热一小片铝箔,熔化的铝会滴落 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.2:1 | C.3:1 | D.2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
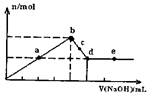
| A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同 |
| B.b点溶液的中c(Na+)=c(C1—) |
| C.b-c段与c-d段溶液中阴离子的物质的量相等 |
| D.在d点,向溶液中加入少量盐酸,沉淀量将减少 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.1:2 | C.1:3 | D.2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com