
【题目】原子序数依次增大的A,B,C,D,E,F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24.
(1)F原子基态的核外电子排布式为 .
(2)在A,B,C三种元素中,第一电离能由大到小的顺序是(用元素符号回答).
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 .
(4)由A,B,C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为 .
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 .
(6)由B,C,D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 . 
【答案】
(1)[Ar]3d54s1
(2)N>O>C
(3)NH3分子之间存在氢键
(4)[N=C=O]﹣
(5)sp
(6)NaNO2
【解析】解:原子序数依次增大的A,B,C,D,E,F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等,原子核外电子排布式为1s22s22p2 , 故A为碳元素;C的基态原子2p能级上的未成对电子数与A原子的相同,则C原子核外电子排布式为1s22s22p4 , 故C为O元素,由原子序数可知B为N元素;F的原子序数为24,则F为Cr;E和C位于同一主族,则E为S元素;D为它所在周期中原子半径最大的主族元素,处于ⅠA族,原子序数大于O元素,故D为Na,(1)F原子核外电子数为24,基态的核外电子排布式为[Ar]3d54s1 , 所以答案是:[Ar]3d54s1;(2)同周期随原子序数增大元素第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于氧元素,故第一电离能N>O>C,所以答案是:N>O>C;(3)NH3分子之间存在氢键,比分子间作用力更强,故其沸点高于CH4 , 所以答案是:NH3分子之间存在氢键;(4)OCN﹣与CO2互为等电子体,价电子总数相等,二者结构类似,则OCN﹣的结构式为[N=C=O]﹣ , 所以答案是:[N=C=O]﹣;(5)元素C与S所形成的常见化合物为CS2 , 分子中S原子价层电子对数=2+ ![]() =2,不含孤对电子,故S原子采取sp杂化,所以答案是:sp;(6)由晶胞结构可知,晶胞中存在[NO2]结构微粒,微粒数目=1:8×
=2,不含孤对电子,故S原子采取sp杂化,所以答案是:sp;(6)由晶胞结构可知,晶胞中存在[NO2]结构微粒,微粒数目=1:8× ![]() =2、Na原子数目=8×
=2、Na原子数目=8× ![]() =2,故该化合物的化学式为NaNO2 , 所以答案是:NaNO2 .
=2,故该化合物的化学式为NaNO2 , 所以答案是:NaNO2 .


科目:高中化学 来源: 题型:
【题目】化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈性,原因是;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于;
(3)已知在H2S溶液中存在下列平衡:H2S═HS﹣+H+①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向移动,(填“左”或“右”)c(H+) . (填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向移动,(填“左”或“右”)c(S2﹣) . (填“增大”、“减小”或“不变”)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”);设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为m2 . 则m1m2 . (选填“<”、“=”、“>”) 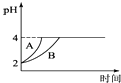
(5)难溶电解质在水溶液中存在溶解平衡.某MgSO4溶液里c(Mg2+)=0.002molL﹣1 , 如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于;(该温度下Mg(OH)2的Ksp=2×10﹣11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究浓硫酸的性质,设计了如下图所示的装置进行实验。
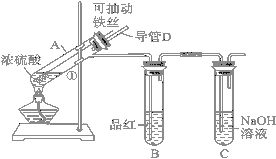
(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是________________。
(2)说明SO2气体产生的实验现象是___________;装置C的作用是______________。
(3)反应一段时间后,他们对试管A中溶液的金属离子进行探究,请完成相关试题:
① 提出假设: 假设1:只含有Fe3+;
假设2:只含有Fe2+;
假设3:既有Fe2+,又有Fe3+。
② 请设计实验方案验证假设3。
限选试剂:稀硫酸、KMnO4溶液、KSCN溶液、NaOH溶液、H2O2溶液。
实验步骤 | 预期现象 |
步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 |
|
步骤二:检验Fe3+,往试管Ⅰ中,_____________ | _________________________ |
步骤三:检验Fe2+,往试管Ⅱ中,______________ | _________________________ |
(4)已知C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的_____
2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的_____
A.脱水性 B.强氧化性 C.吸水性
若要验证反应产物中同时混有SO2气体和CO2气体,可选择以下试剂进行实验:
NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液
选择合适试剂,并安排合理的顺序为_____________________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】23592U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会所关注。23592U左上角的“235”表示( )
A.质量数B.中子数C.质子数D.电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有_________________离子,一定不含有_________离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程)_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 | NaOH物质的量浓度 | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 .
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”).混合液中离子浓度c(A﹣)与 c(Na+)的大小关系是 .
(3)丙组实验结果分析,HA是酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是 .
(4)丁组实验所得混合溶液中由水电离出的c(OH﹣)=molL﹣1 . 写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)﹣c(A﹣)=molL﹣1 c(OH﹣)﹣c(HA)=molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com