
��18�֣�ij��ѧ�о���ѧϰС�������ȡ������̽�������ʵķ�����������ͼ��ʾװ�����ʵ�顣��A�з�����Ӧ�Ļ�ѧ����ʽΪ��MnO2 + 4HCl��Ũ�� ==== MnCl2 + Cl2�� + 2H2O��
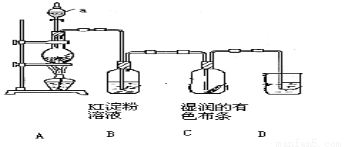
��ʵ��̽����
��1��װ��A�У�����a�������� ��
��2��װ��B����ɫ��Һ����Ϊ ɫ���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��3��װ��C��ʪ�����ɫ���� �����ɫ������ɫ��������ԭ����������ˮ��Ӧ������ ���ѧʽ��
��4��Ϊ�����ն������������ֹ��ɿ�����Ⱦ��װ��D��Ӧʢ�� ____��Һ���NaOH����H2SO4����
��5����8.7gMnO2������Ũ���ᷴӦ�������Ͽ������ɱ�״���µ�Cl2 _______L��
��֪ʶ��չ��
��6��ijͬѧ�������ϵ�֪�����������Ũ�����ڳ�����Ҳ����������������Ӧ�Ļ�ѧ����ʽΪ��
2KMnO4 + 16HCl��Ũ�� ==== 2KCl + 2MnCl2 + 5Cl2�� + 8H2O�����÷�Ӧ���������� ���KMnO4����HCl����
��֪ʶӦ�á�
��7�����ֹ�������ˮ������ɱ�������ƴ��ģ��Ⱦ������������Ҫ��ʩ֮һ�������о�һ��������ˮ��������ɱ���ĺ���������______________________________________________________________________
24����18�֣�(1) ��Һ©�� (2) �� 2KI + Cl2 = 2KCl + I2
(3)��ɫ HClO (4) NaOH (5) 2.24 (6) KMnO4
(7)������ˮ������Ư�ۣ�������еȷ�����
��������
�����������1�����������ص㣬����a�������Ƿ�Һ©����
��2���������������ԣ��ܽ������������ɵⵥ�ʣ�����������⻯����Һ��ӦCl2+2KI�T2KCl+I2����I2��I2�����۱����������������Ϊ������Cl2+2KI�T2KCl+I2��
��3��ʪ��ĺ�ɫ�����е�ˮ��������Ӧ��������ʹ����ᣬ���ɵ�HClO����Ư���ԣ���ʪ��ĺ�ɫ����Ư����ɫ����Ϊ����ɫ��HClO��
��4����������Ⱦ�����岻���ŷŵ������У���Ҫ������������Һ���չ�����������������NaOH��Ӧ�����Ȼ��ƺʹ������ƣ���Ӧ�Ļ�ѧ����ʽΪCl2+2NaOH=NaCl+NaClO+H2O����Ϊ��NaOH��
��5����5��8.7g��MnO2�����ʵ���=8.7/87=0.1mol����
MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O
0.1mol 0.1mol ��������0.1mol, �ڱ�״���µ����Ϊ2.24L��
��6����2KMnO4+16HCl��Ũ��=2KCl+2MnCl2+5Cl2��+8H2O�ķ�Ӧ�У�MnԪ�ػ��ϼ۽��ͣ�����KMnO4 ������������Ϊ��KMnO4��
��7��������ˮ������Ư�ۣ�������еȷ�����
���㣺����ʵ����������ԭ�����������ʵļ��飬β�����գ���ѧ�����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭����У9�������߶���ѧ�Ծ��������棩 ���ͣ������
��10�֣� ����̼ѭ������������ĸ߶����ӣ���֪ú������ȿ�����ˮ������Ӧ������CO��H2Ϊ���ĺϳ������ϳ����й㷺Ӧ�á��Իش��������⣺
��1����¯������CO�������Ҫ��;֮һ���������ӦΪ��FeO(s)��CO(g) Fe(s)��CO2(g) ��H��0����֪��1 100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
Fe(s)��CO2(g) ��H��0����֪��1 100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
���¶����ߣ���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��ʱƽ�ⳣ��Kֵ (���������С�����䡱)��
��1 100 ��ʱ��ø�¯�У�c(CO2)=0.025 mol��L-1��c(CO)=0.1 mol��L-1��������������£��÷�Ӧ�� ����(����ҡ�)���ж������� ��
��2��Ŀǰ��ҵ��Ҳ����CO2������ȼ�ϼ״����йط�ӦΪ��
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ��H=��49.0KJ/mol���������Ϊ1L���ܱ������г���1mol CO2��3molH2����Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H=��49.0KJ/mol���������Ϊ1L���ܱ������г���1mol CO2��3molH2����Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ��
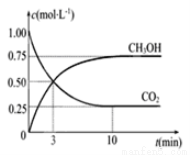
�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����V��H2��=------------��
�ڷ�Ӧ�ﵽƽ������д�ʩ��ʹ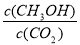 �������-------������ţ�
�������-------������ţ�
A�������¶� B���ٳ���H2 C���ٳ���CO2 D����H2O��g������ϵ�з��� E������He��g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�����и߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
����ʳƷ���Ӽ�������Ӧ��ȷ��һ����
A����ɫ��_______��������
B�����_______��������
C��Ӫ��ǿ����_______��ʳ��Ʒ�м�������
D��������_______�Ȳ˺�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�����и߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
������Ⱦ�ѳ�Ϊ����������ٵ��ش���в�����ж�Ӧ��ϵ����ȷ����
| �������� | ��ɻ����������Ҫ���� |
A | ���� | �������� |
B | ����ЧӦ | ������̼ |
C | ��ɫ��Ⱦ | �������� |
D | ������ն� | ���ȴ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�����и߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
ʳ����ά�����������ͽ�����֧�����±���ijʳƷ��װ���ϵ�˵����
Ʒ�� | �߲��մ�� |
���� | ��ۡ��ʼ���������ʳ��ֲ���͡���ɰ�ǡ����͡�ʳ�Ρ���ˮ��ˡ���֭ |
������ | ʮ������ |
�������� | 2008��11��6�� |
���ϱ��и������ϳɷֵ����ⲻ��ȷ����
A�����������ʵ����ʼ���
B������ά���ص�����ˮ��˺ͳ�֭
C���������۵�����ۺͰ�ɰ��
D��������֬���Ǿ���ʳ��ֲ���ͺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�︣��ʡ�߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
����ʵ�������ȷ����
A������Ͳ��ȡ5.0 mLŨ���Ტֱ������Ͳ��ϡ��
B�����촵��ȼ�ŵľƾ��ƻ���
C������NaOH����ʱ����ҩƷֱ�ӷ���������
D������ƿ���Һ�����ʱ������ʯ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�︣��ʡ�߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ����������ԭ��Ӧ����
A��H2 + CuO == Cu + H2O
B��Na2O + H2O== 2 NaOH
C��CaCO3==CaO + CO2��
D��KOH + HNO3== KNO3 + H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�人�и߶���ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ᡢ���ᡢ��������ᶼ��ǿ�ᣬ��������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣����
�� | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6��10��5 | 6.3��10��9 | 1.6��10��9 | 4.2��10��10 |
�ӱ������ж�����˵���в���ȷ����
A���ڱ��������������ᶼû����ȫ����
B���ڱ������и�������������������ǿ����
C���ڱ�����������ĵ��뷽��ʽΪH2SO4��2H���� SO42��
D��ˮ�������������ǿ��û���������������ڴ����п����������������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���㽭ʡ���ݵ�����У�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��12�֣���̼���ú�������Դ��������Դ��ú�����г����о���ͬ�¶��µ�ƽ�ⳣ����Ͷ�ϱȼ���ֵ�����⡣
��֪��CO(g)��H2O(g) H2(g)��CO2(g)��ƽ�ⳣ�����¶ȵı仯���±���
H2(g)��CO2(g)��ƽ�ⳣ�����¶ȵı仯���±���
�¶�/�� | 400 | 500 | 850 |
ƽ�ⳣ�� | 9.94 | 9 | 1 |
��ش��������⣺
��1���÷�Ӧ�淴Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK �� ��
��2����������Ӧ������ ��Ӧ������ȡ������ȡ�����
��3��850��ʱ�����Ϊ10L��Ӧ���У�ͨ��һ������CO��H2O(g)����������Ӧ��CO��H2O(g)Ũ�ȱ仯����ͼ����0��4 min��ƽ����Ӧ����v(CO)�� mol��L��1��min��1��

��4��t1�棨����850�棩ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯�����
�ٱ���3 min��4 min֮�䷴Ӧ���� ״̬��C1��ֵ 0.08 mol��L��1������ڡ�С�ڻ���ڣ���
�ڷ�Ӧ��4 min��5 min��ƽ�����淽���ƶ������ܵ�ԭ���� ����ѡ��������5 min��6 min֮����ֵ�����仯�����ܵ�ԭ���� ����ѡ����
A������ˮ���� B�������¶� C��ʹ�ô��� D����������Ũ��
��5������500��ʱ���У���CO��H2O����ʼŨ�Ⱦ�Ϊ0.020 mol��L��1���ڸ������£�CO�����ת����Ϊ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com