
采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取绿矾(FeSO4·7H2O),某学习小组设计了如下流程:
下列说法错误的是
A.酸浸时选用足量硫酸,试剂X为铁粉
B.滤渣a主要含SiO2,滤渣b主要含Al(OH)3
C.从滤液B得到绿矾产品的过程中,必须控制条件防止其氧化和分解
D.试剂X若为过量NaOH溶液,得到的沉淀用硫酸溶解,再结晶分离也可得绿矾
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:2016-2017学年广西省高一上模拟考试化学卷(解析版) 题型:实验题
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼铜的反应为:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.用稀盐酸浸取炉渣,过滤,除掉的杂质为 。
b.除去Al3+的离子方程式是 。
c.选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸 稀硫酸 KSCN溶液KMnO4溶液NaOH溶液所选试剂为 。证明炉渣中含有FeO的实验现象为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上模拟考试化学卷(解析版) 题型:选择题
下列说法中,正确的是
A. H35Cl、H37Cl属于同素异形体
B. 16O与18O的中子数不同,核外电子排布却相同
C. 稳定性:CH4>SiH4;还原性:HCl>H2S
D. K+、Ca2+、Mg2+的离子半径依次增大,还原性依次增强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上模拟考试化学卷(解析版) 题型:选择题
实验中的下列操作正确的是
A. 用试管取试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量试剂倒入试剂瓶中
B. Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水池中,再用水冲入下水道
C. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部蒸干才停止加热
D. 用浓硫酸配制一定物质的量浓度的稀硫酸,浓硫酸溶于水后,冷却至室温后转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三第二次诊断性考试化学试卷(解析版) 题型:推断题
[化学—选修3:物质结构与性质]A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是 ,基态D原子价电子的轨道表达式为 。
(2)DA2分子的VSEPR模型是 。H2A比H2D熔沸点高得多的原因是 。
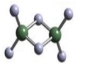
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
① C2Cl6属于 晶体(填晶体类型),其中C原子的杂化轨道类型为 杂化。
② [C(OH)4]-中存在的化学键有 。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是 。
(5)B、C的氟化物晶格能分别是2957 kJ·mol-1、5492 kJ·mol-1,二者相差很大的原因是____________。
(6)D与E所形成化合物晶体的晶胞如图所示。
① 在该晶胞中,E的配位数为______________。
② 原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(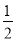 ,0,
,0,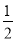 );c为(
);c为(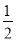 ,
,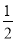 ,0)。则d原子的坐标参数为_________________。
,0)。则d原子的坐标参数为_________________。
③ 已知该晶胞的密度为ρ g/cm3,则其中两个D原子之间的距离为_________ pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三第二次诊断性考试化学试卷(解析版) 题型:选择题
化学与生产、生活和科研密切相关,下列说法错误的是
A. 用菜籽油浸泡花椒制得花椒油的过程未发生化学变化
B. 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用
C. 把浸泡过KMnO4溶液的硅藻土放在水果箱里可延长水果的保鲜期
D. 对医疗器械高温消毒时,病毒蛋白质受热变性
查看答案和解析>>
科目:高中化学 来源:2017届天津市五区县高三上学期期末考试化学试卷(解析版) 题型:选择题
工业上用Fe2(SO4)3酸性溶液处理SO2废气的工艺流程如下,下列说法不正确的是)

A.溶液的pH:①>②>③
B.整个过程中Fe2(SO4)3溶液可以循环利用
C.溶液②转化为溶液③发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O
D.向②溶液中滴加KSCN溶液,溶液可能变为血红色
查看答案和解析>>
科目:高中化学 来源:2017届四川省资阳市高三第二次诊断性考试化学试卷(解析版) 题型:填空题
NO2是形成雾霾天气的原因之一。
(1)重型车辆常在排气管内喷淋尿素[CO(NH2)2]溶液,使NO2转化为无污染物质。采用“喷淋”的目的是 ,反应的活化能 (选填“增大”“减小”“不变”),写出该反应的化学方程式: 。【已知:CO(NH2)2中N呈-3价】
(2)以CO2与NH3为原料可合成化肥尿素。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s) =CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式 。
(3)恒温下将1.6 mol NH3和0.8 mol CO2放入容积为8 L的恒容密闭容器中,反应生成NH2CO2NH4(s),下列各项能说明反应达到平衡状态的是 。
a.容器内气体压强保持不变 b.CO2与NH3的速率之比为1∶2
c.NH2CO2NH4(s)质量保持不变 d.容器内温度保持不变
该反应达到平衡时,测得CO2的物质的量浓度为0.05 mol·L-1。则平衡时CO2的转化率α= ;若其他条件不变,移去少量NH2CO2NH4,CO2的转化率 (选填“增大”“减小”“不变”)。
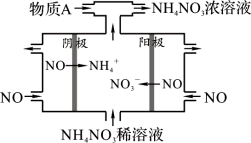
(4)为减少NO2排放,可将NO2转化为NO后通入如右图所示装置,同时补充气体物质A使NO全部转化为NH4NO3,该装置中总化学反应方程式是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省定西市通渭县高二上学期期末化学试卷(解析版) 题型:选择题
下列实验装置图与对应的现象或结论的叙述均正确的是( )
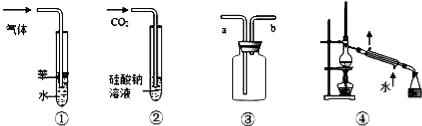
A.装置①:可用于吸收NH3或HCl气体,并防止倒吸
B.装置②:持续通入CO2气体,先出现白色沉淀 ,后变澄清
,后变澄清
C.装置③:若“a进b出”可用于收集NO2,若“b进a出”可用于收集NH3
D.装置④:可用于分离石油,得到汽油、煤油和柴油等各种纯净物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com