
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
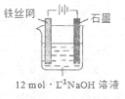
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为 ,正极反应为: 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L,含有2.0×l0-4 mol·L-l K2FeO4的废水中有CaFeO4沉淀产生,理论上至少加入Ca(OH)2的物质的量为 mol。
【知识点】氧化还原反应规律、电化学、难溶物的沉淀溶解平衡 B3 F3 H5
【答案解析】(1)K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质。11.50
(2)
①3:1(2分)
② 2FeO42-+Fe3++8OH-=3FeO43-+4H2O(2分)
③Fe+8OH--6e─=FeO42─+4H2O(2分)
(3)Zn(1分) FeO42-+4H2O+3e-== Fe(OH)3+5OH-(2分)
(4)2.27×10-2(2分)
解析:(1)所给方程式体现了K2FeO4具有强氧化性,能够消毒杀菌,同时FeO42- 被还原成Fe3+;结合胶体的性质想到第二点:Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质。 根据反应方程式可知酸会促进K2FeO4水解,而碱会抑制K2FeO4水解,所以在碱性强的溶液中能稳定存在。
(2)
①反应Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O中,Fe元素化合价升高,化合价由+3价升高到+6价被氧化,N元素化合价由+5价降低到+2价,氧化剂与还原剂的物质的量之比为3:1,
② 根据提示:2FeO42-+Fe3++8OH-=3FeO43-+4H2O
③制备中间产物Na2FeO4利用电解法,结合阳极发生氧化反应得:Fe+8OH--6e─=FeO42─+4H2O
(3)放电时为原电池,锌的化合价升高锌做负极;正极发生的电子的反应: FeO42-+4H2O+3e-== Fe(OH)3+5OH-
(4)至少加入Ca(OH)2的物质的量为: =2.27×10-2(mol)
=2.27×10-2(mol)
【思路点拨】本题考查了氧化还原反应规律、电化学、难溶物的沉淀溶解平衡,注意根据题目提示进行分析解答。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
给下列苯的同系物命名
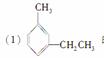 的系统名称为
的系统名称为
________________________________________________________________________。
 的系统名称为
的系统名称为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
.某强氧化剂XO(OH)2+被Na2SO3还原。如果还原2.4×10-3mol XO(OH)2+,需用30mL 0.2mol/L的Na2SO3溶液,那么X元素被还原后的价态是
A.+2 B.+1 C.0 D.-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X和Y是两种单质,X+Y→X2++Y2- ,现有下列叙述正确的是: ①X被氧化 ②X是氧化剂 ③Y2-是还原产物 ④X2+具有氧化性 ⑤Y2-具有还原性 ⑥Y单质氧化性比X2+氧化性强
A.①②③ B.①②⑥ C.①③④⑤⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
据最新报道,科学家发现了如下反应:O2+PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列叙述正确的是
A.在此反应中,每生成1molO2(PtF6),则转移1mol电子
B.在此反应中,O2是氧化剂,PtF6是还原剂
C.O2(PtF6)中氧元素的化合价是+1价
D.O2(PtF6)中仅存在离子键不存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组取一定质量的Fe SO4固体,利用图中装置进行实验。
SO4固体,利用图中装置进行实验。
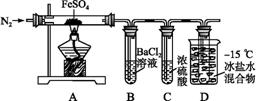
| 实验过程 | 实验现象 | |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应, | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2熔点为-72 ℃,沸点为-10 ℃;SO3熔点为16.8 ℃,沸点为44.8 ℃。
(1)实验③反应的离子方程式是 。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有 气体,依据是 。
(3)实验④反应的离子方程式是 。
(4)某同学依据B中的现象,认为FeSO4 分解一定有SO3生成。你认为是否正确,其原因是 (用必要的文字和化学方程式解释)。
分解一定有SO3生成。你认为是否正确,其原因是 (用必要的文字和化学方程式解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com