
| A、32 g氧气和臭氧的混合气体中所含的原子数为2N. |
| B、常温常压下,22.4LCO2含有的分子数目为NA |
| C、0.1mol OH-含有NA个电子 |
| D、2.4g金属镁与足量的盐酸反应,转移的电子数为0.2NA |
| m |
| M |
| 32g |
| 16g/mol |
| m |
| M |
| 2.4g |
| 24g/mol |


科目:高中化学 来源: 题型:
| A、11.7g |
| B、23.4 g |
| C、26.5g |
| D、58.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
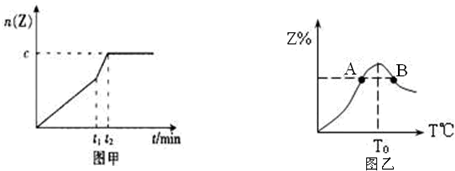
查看答案和解析>>
科目:高中化学 来源: 题型:
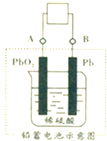 电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:| 放电 |
| 充电 |
| A、放电时电极 PbO2 发生氧化反应 |
| B、放电时电子流向由A到B |
| C、工作时蓄电池里电解质溶液的pH不变 |
| D、放电时正极反应是PbO2+2e-+4H++SO42-═PbSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g Na2O2与足量CO2充分反应时电子转移数为2NA |
| B、NA个氯气分子的体积为22.4L |
| C、4℃、101kPa时,54mL H2O中含有的分子数为3NA |
| D、1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧热指的是可燃物完全燃烧生成稳定的氧化物所放出的热量 |
| B、勒夏特列原理指的是,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动 |
| C、盐溶液不一定显中性,不显中性的盐都会促进水的电离 |
| D、电镀是利用原电池原理在某些金属表面镀上一薄层其他金属或合金的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硼酸钛[(TiO)2(B2O5)?4H2O]是一种高效节能润滑油添加剂,可用硫酸氧钛和硼砂的溶液为原料湿法合成.
硼酸钛[(TiO)2(B2O5)?4H2O]是一种高效节能润滑油添加剂,可用硫酸氧钛和硼砂的溶液为原料湿法合成.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com