
| A. | 天然气的主要成分是CH4 | |
| B. | 酸性:乙酸>碳酸>次氯酸 | |
| C. | 淀粉、纤维素、蚕丝、油脂都是高分子化合物 | |
| D. | 石油的分馏产品如汽油、煤油、柴油等都是混合物 |
分析 A.天然气的主要成分是甲烷;
B.根据强酸制弱酸的原理分析;
C.高分子化合物的相对分子质量一般达1万以上、一般具有重复结构单元;
D.纯净物是单一的一种物质.
解答 解:A.甲烷是天然气的主要成分,故A正确;
B.根据强酸制弱酸的原理,乙酸与碳酸钠反应能生成碳酸,所以乙酸酸性比碳酸强;碳酸与次氯酸钙反应能生成次氯酸,所以碳酸酸性比次氯酸强,所以酸性强弱:乙酸>碳酸>次氯酸,故B正确;
C.油脂相对分子质量较小,不是高分子化合物,故C错误;
D.汽油、煤油、柴油是多种烃组成的混合物,故D正确.
故选C.
点评 本题考查天然气的成分、高分子化合物、酸性比较以及混合物等,题目难度不大,注意汽油、煤油、柴油是多种烃组成的混合物,注意规律的掌握理解.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液和盐酸反应后溶液中的钠盐: | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: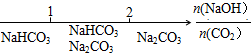 | |
| C. | Fe与稀硝酸反应的氧化产物: | |
| D. | AlCl3溶液中滴加氨水后铝元素的存在形式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )
有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )| A. | 物质酸性的比较:HB>HA>H2CO3 | |
| B. | 反应结束后所得两溶液中,c(B-)>c(A-) | |
| C. | 上述三种溶液中由水电离的c(OH-)大小:NaHCO3溶液>HB溶液>HA溶液 | |
| D. | HA溶液和NaHCO3溶液反应所得溶液中:c(A-)+c(HA)=0.10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ①和④ | C. | ②和④ | D. | ②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | NaAl02 | C. | Mgcl2 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com