
下列各组离子中,能在强酸性溶液中大量共存的是( )
A. Na+、K+、SO42﹣、OH﹣ B. Na+、K+、Cl﹣、HCO3﹣
C. Na+、Cu2+、CO32﹣、Br﹣ D. Na+、Mg2+、NO3﹣、Cl﹣
考点: 离子共存问题.
分析: 强酸性溶液中存在大量氢离子,
A.氢离子与氢氧根离子反应;
B.碳酸氢根离子与氢离子反应生成二氧化碳气体和水;
C.铜离子与碳酸根离子反应,碳酸氢根离子与强酸反应;
D.四种离子之间不发生反应,都不与氢离子反应.
解答: 解:A.OH﹣与强酸反应,在溶液中不能大量共存,故A错误;
B.HCO3﹣与强酸溶液中的氢离子反应,在溶液中不能大量共存,故B错误;
C.Cu2+、CO32﹣之间发生反应,CO32﹣与强酸反应,在溶液中不能大量共存,故C错误;
D.Na+、Mg2+、NO3﹣、Cl﹣离子之间不反应,且都不与强酸反应,在溶液中能够大量共存,故D正确;
故选D.
点评: 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH﹣.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
物质A有如下反应路线:
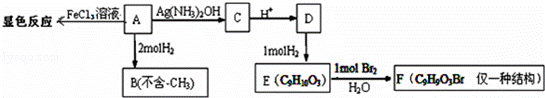
(1)1mol 物质A最多能消耗H2的物质的量为
(2)A→C的化学方程式为 ;
(3)H、G与B互为同分异构,且满足下列条件:①H、G与浓溴水和NaHCO3都不反应,且结构中均不含有﹣CH3(官能团不能同时连在同一个碳原子上). ②1molH、G 都能与2molNa反应. ③H环上一氯取代只有2种,G环上一氯取代只有3种.
H的结构简式为 ;G的一种结构简式为 .
(4)已知在一定条件下R1CH=CHR2→R1CHO+R2CHO,A在一定条件下氧化生成羧酸X、Y.X是芳香族化合物,Y是一种还原性的二元羧酸.
写出X在浓硫酸条件下的缩聚反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,Cl﹣的物质的量浓度与50mL 1mol/L AlCl3溶液中Cl﹣物质的量浓度相等是()
A. 100mL 1mol/LNaCl溶液 B. 150mL 3mol/LKCl溶液
C. 75mL 1mol/LMgCl2溶液 D. 25mL 2mol/LAlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
在溶液中能大量共存的离子组是( )
A. Na+、OH﹣、HCO3﹣ B. Ba2+、OH﹣、Cl﹣
C. H+、K+、CO32﹣ D. NH4+、NO3﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
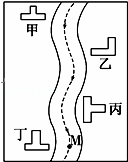
某小河边有四座工厂:甲、乙、丙、丁(如图所示).已知,它们所排出的废液里分别含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某环保小组对河水监测时发现:①甲处河水呈乳白色②乙处河水呈红褐色浑浊状③丙处河水由浑浊变清④丁处河水产生气泡,河水仍澄清.
请推断:
(1)四座工厂排出的废液里含有的污染物是甲 ,乙 ,丙 ,丁 .
在M处取出的河水中,肯定大量存在的离子有 .
(3)用离子方程式表示丙除河水变澄清的原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液中可能有下列阴离子中的一种或几种:Cl﹣、OH﹣、CO32﹣、SO32﹣、SO42﹣.
(1)当溶液中有大量的H+存在时,不可能大量存在.
当溶液中有大量的Ba2+存在时,不可能大量存在 .
(3)当溶液中有大量的 存在时,上述所有阴离子都不可能大量存在.
查看答案和解析>>
科目:高中化学 来源: 题型:
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.1mol/L FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是 、
(2)下列有关配制过程中说法错误的是 (填序号).
a.用电子天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90nL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br﹣被C12氧化成Br2溶解在溶液中; 假设2:Fe2+被C12氧化成Fe3+.
(1)请你完成表格,验证假设:
实验步骤、预期现象 结论
①溶液中加入适量四氯化碳 假设1正确
②向溶液中加入 假设2正确
若假设1正确,从实验①中分离出Br2的实验操作名称是 ;
(2)实验证明:还原性Fe2+>Br﹣,请用一个离子方程式来证明: ;
(3)若在50mL上述FeBr2溶液中通入5×10﹣3molCl2,反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com