
| A. | 两清液混合,AgCl和AgI都沉淀 | |
| B. | 向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大 | |
| C. | 若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L | |
| D. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 |
分析 饱和的AgCl溶液中:c(Ag+)=c(Cl-)=1.342×10-5,饱和的AgI溶液中:c(Ag+)=c(I-)=1.0×10-8,等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6,溶液中c(Cl-)>c(I-),以此解答该题.
解答 解:饱和的AgCl溶液中:c(Ag+)=c(Cl-)=1.342×10-5,饱和的AgI溶液中:c(Ag+)=c(I-)=1.0×10-8,等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6,
A.等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6,明显,混合后,AgI必然沉淀,AgCl则不然,故A错误;
B.Ksp与温度有关,温度不变,Ksp不变,故B错误;
C.常温下,氯化银的溶解度为:1.342×10-5×143.5═0.00192(g),c(Cl-)═1.342×10-5mol/L,0.1435克AgCl只有少量溶解,故c(Cl-)═1.342×10-5mol/L,故C错误;
D.由于c(Cl-)》c(I-),若AgNO3固体足量,沉淀以AgCl为主,故D正确.
故选D.
点评 本题考查难溶电解质的生成,为高频考点,把握AgI更难溶且碘离子浓度小为解答的关键,侧重分析与应用能力的考查,注意沉淀生成的判断,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 少量的浓硫酸或浓NaOH沾到皮肤上,应用大量的水反复冲洗,再涂抹相应的药品 | |
| B. | 氢气还原氧化铜,一般先预热氧化铜,然后再通入氢气 | |
| C. | 浓硝酸需用细口棕色试剂瓶密封保存 | |
| D. | 实验室制备有毒气体应在通风橱中进行,且必须对尾气进行吸收或处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知pAg=-lg(Ag+),Ksp(AgCl)=1×10-12.如图是向10ml AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知pAg=-lg(Ag+),Ksp(AgCl)=1×10-12.如图是向10ml AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 相同温度下,AgCl在纯水和在NaCl溶液中的溶解度相等 | |
| B. | 原AgNO3溶液的物质的量浓度为0.1mol/L | |
| C. | 图中x的坐标为(100,6) | |
| D. | 0.1mol/L的NaCl溶液换成0.1mol/L的NaI溶液时,图象变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
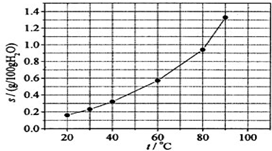
| A. | 温度升高时溴酸银溶解速度加快 | |
| B. | 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-4 | |
| D. | 溴酸银的溶解是放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,80℃时反应:2NO(g)+O2(g)?2NO2(g),反应体系中,n(NO)随时间t的变化如表
在2L密闭容器内,80℃时反应:2NO(g)+O2(g)?2NO2(g),反应体系中,n(NO)随时间t的变化如表| 时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5KJ•mol-1(燃烧热) | |
| B. | C2H5OH+3O2═2CO2+3H2O△H=-1368.8KJ•mol-1(反应热) | |
| C. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=-114.6KJ•mol-1(中和热) | |
| D. | 2H2O(g)═2H2(g)+O2(g)△H=+483.6KJ•mol-1(反应热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com