
【题目】氢氧燃料电池是一种常见化学电源,其原理反应:2H2+O2=2H2O,其工作示意图如图。下列说法不正确的是
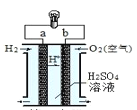
A. a 极是负极
B. b 电极上发生还原反应
C. 正极的电极反应式为:O2+2H2O+4e-=OH-
D. 放电前后电解质溶液的pH发生改变
【答案】C
【解析】
氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,据此答题。
A.氢氧燃料电池中,在电极上反应的是氢气和氧气,通入氢气的a极为电源的负极,通入氧气的b极为原电池的正极,故A正确;
B.氢氧燃料电池中,负极上通入燃料,发生氧化反应,正极上通入氧气,发生还原反应,即氧气在b极上发生还原反应,故B正确;
C.氢氧燃料电池中,通入氧气的b极为原电池的正极,电解质溶液为硫酸溶液,该电极上发生得电子的还原反应,电极方程式为:O2+4H++4eˉ=2H2O,故C错误;
D.氢氧燃料电池的总反应式是氢气燃烧生成水的反应,电解质硫酸溶液的酸性减弱,pH值增大,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。

I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(3)装置C的作用是__________________________。
(4)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________,KMnO4标准溶液用______(酸或碱)式滴定管,产品的纯度为_______(列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (6) 产物中含有 _________________ |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为 ___________________________ |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8)____________________ | (9) 溶液中含有 _______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2 和 Cl2 反应的微观过程可用右图表示,下列有关说法正确的是
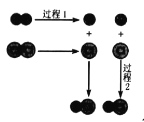
A. 过程 1 释放能量B. 过程 2 吸收能量
C. 该反应为吸热反应D. 反应物总能量高于生成物总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中位于金属和非金属元素交界处最容易找到的材料是( )
A.半导体材料B.制催化剂的材料
C.制农药的材料D.耐高温、耐腐蚀的合金材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
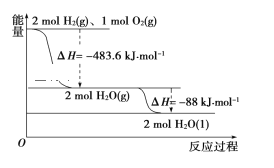
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 同温同压下甲烷和氧气的密度之比为2∶1
B. 1 g甲烷和1 g氧气的原子数之比为5∶1
C. 等物质的量的甲烷和氧气的质量之比为2∶1
D. 在标准状况下等质量的甲烷和氧气的体积之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4的正确表达式为
A. △H4= 2/3(△H1+△H2- 3△H3) B. △H4= 2/3(3△H3-△H1-△H2)
C. △H4= 3/2(△H1+△H2- 3△H3) D. △H4= 3/2(△H1-△H2- 3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子 | Na+ Al3+ Fe3+ Cu2+、 Ba2+ |
阴离子 | OH- Cl- CO32- NO3- SO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、C的化学式为:A______________;C______________。
(2)写出步骤②中发生反应的化学方程式____________________________________。
(3)D溶液中滴入石蕊试液,现象是___________________________________________,原因是_____________________________________________(用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是____________mL。
(5)现用500 mL 3 mol·L-1的E溶液充分吸收11.2 L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为_________________________________。
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水)。_________
 ’。
’。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com