
【题目】2015年国产C919大型客机正式下线,标志着我国成为世界上少数几个具有自行研制大型飞机的国家之一,标志着我国航空工业进入了新的发展阶段.
I. 飞机的外壳通常采用钛铝合金材料。
(1)基态Ti原子的价电子轨道表示式为__________。
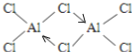
(2)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为_______________________________ (标明配位键)。
(3)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为__________________________________。
II. 现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料--玻璃纤维增强塑料,其成分之一为环氧树脂。
(4)常见的E51型环氧树脂中部分结构如下图所示:
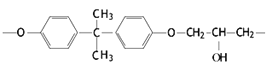
其中碳原子的杂化方式为________,它们的个数比为______。
III. 大型飞机的发动机被誉为航空工业皇冠上的“宝石”。制造过程中通常采用碳化钨做关键部位的材料
(5)钨元素位于周期表的第六周期第VIB族,已知该元素价电子不遵循半充满排布规律,请写出其外围电子排布式___________。
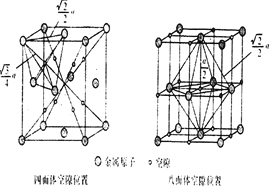
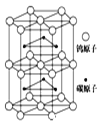
(6)下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有______个,1个钨原子周围距离钨原子最近的碳原子有____个,C原子填入钨原子组成的_____空隙。钨原子填入碳原子组成的_________空隙。下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是______
A.FeCuB.TiAu C.MgZnD.CuAg
(7)假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为Mg/mol,密度为bg/cm3,则阿伏加德罗常数NA用上述数据可以表示为___________________
【答案】 ![]()
 3NaAlH4=Na3AlH6+2Al+3H2↑ sp2、sp3 2: 1 5d46s2 6 6 四面体 【答题空10】八面体 C
3NaAlH4=Na3AlH6+2Al+3H2↑ sp2、sp3 2: 1 5d46s2 6 6 四面体 【答题空10】八面体 C ![]()
【解析】I.⑴. Ti原子核外电子数为22,价电子排布式为3d24s2,价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
⑵. 氯化铝在178℃时升华,熔沸点较低,属于分子晶体,蒸气的相对分子质量约为267,蒸气分子的分子式为Al2Cl6,铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键,结构式如图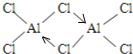 ,故答案为:
,故答案为: ;
;
⑶. NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,根据原子守恒可知:3NaAlH4→Na3AlH6+2Al+3H2,反应方程式为:3NaAlH4=Na3AlH6+2Al+3H2↑,故答案为:3NaAlH4=Na3AlH6+2Al+3H2↑;
II.⑷. 分子中碳原子均没有孤对电子,苯环中C原子形成3个σ键、其它碳原子形成4个σ键,杂化轨道数目分别为3、4,分别采取sp2、sp3杂化,二者原子数目之比为12:6=2:1,故答案为:sp2、sp3;2:1;
⑸. 钨元素位于周期表的第六周期第VIB族,其外围电子排布式为:5d46s2,故答案为:5d46s2;
⑹. 在此结构中钨原子数目为1+2×1/2+12×1/6+6×1/3=6,由体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个,C原子填入钨原子组成的四面体空隙,钨原子填入碳原子组成的八面体空隙,碳化钨晶胞中碳原子和钨原子所处位置为六方最密堆积,与Mg的堆积方式相同,故答案为:6;6;四面体;八面体;C;
⑺. 该结构中W原子数目为6,C原子数目为6,则该结构质量为6×Mg/mol÷NAmol1,所以6×Mg/mol÷NAmol1=Vcm3×bg/cm3,故NA=6M/bV,故答案为: ![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为探究温度对酶活性的影响,某生物兴趣小组设计了如下实验方案。
①取6支试管,分别向其中加入4mL淀粉溶液;
②将试管分别放入0℃、20℃、40℃、60℃、80℃、100℃的恒温水浴锅中保温5min;
③向装有淀粉溶液的试管中滴加2滴淀粉酶溶液,立即放回水浴锅中并计时;
④每隔1分钟取2滴左右淀粉溶液,滴于多孔反应板上,滴加1滴碘液检测。记录取出的样液遇碘不呈蓝色所需的时间t。
分析回答下列问题:
(1)该实验的自变量是________________________________。
(2)不能选择过氧化氢酶和过氧化氢溶液进行探究,是因为_____________________________。
(3)该方案中淀粉酶溶液滴加2滴,不能过多,主要是为了避免___________________________。
(4)记录的实验结果如下表(“—”表示没有记录到实验结果):
温度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
平均时间t | — | 7min | 3min | 2min | 7min | — |
请根据表中信息,用柱形图的形式表示温度对该酶活性的影响。___________________________。

实验结果表明该淀粉酶的最适温度范围是_______________。为进一步确定最适温度,需要________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是( )
A.氨气通入稀硫酸 NH3+H+═NH4+
B.稀烧碱溶液和氯化铵溶液混合 NH4++OH﹣═NH3H2O
C.碳酸氢铵和足量浓烧碱溶液混合加热 NH4++OH﹣═NH3↑+H2O
D.Cl2和水反应 Cl2+H2O═H++Cl﹣+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液,可能含有下列离子:Mg2+、A13+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-。取该溶液进行如下实验:①取溶液少许,滴入AgNO3溶液产生白色沉淀;②取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解;③取一定量的原溶液,加入一种淡黄色粉末状的固体X,产生气体的物质的量(n气体)、沉淀的物质的量(n沉淀)与加入淡黄色粉末的量(nx)的关系如下图所示(假设生成的气体全部逸出)。

根据实验现象和数据分析正确的是
A. 溶液中肯定大量存在的阳离子只有Mg2+、A13+、NH4+
B. 溶液中肯定没有的离子只有Fe3+、Ba2+
C. 当加入0.6mol淡黄色粉末时,生成两种气体分别为NH3和O2,其对应的体积比为2:3
D. 溶液中可能存在Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X的单质是一种理想能源,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
(1)Y在元素周期表中的位置为 .
(2)上述元素中,非金属气态氢化物还原性最强的是(写化学式).Y和Z形成的含有共价键的化合物的电子式为 .
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 . (写出其中两种物质的化学式).
(4)ZX与水剧烈反应产生X的单质,其化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com