
分析 Ⅰ.(1)D是具有氧化性的单质,A元素属于短周期主族金属元素,根据反应关系可知A为Na,B为Na2O,D为O2,C为Na2O2;若D为金属,由转化关系可知为变价金属,应为Fe,则C含有Fe2+,具有还原性;
(2)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→AlO2-;D为OH-;或AlO2-→Al(OH)3→Al3+;D为H+;
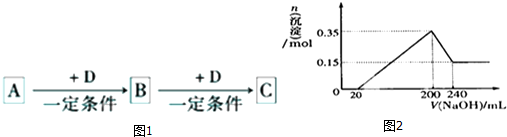
(3)由图可知,200~240mL为氢氧化铝与氢氧化钠反应,可知n[Mg(OH)2]=0.15mol,根据Mg元素守恒可知:m(Mg)=0.15mol×24g/mol=3.6g,沉淀最大时为氢氧化镁、氢氧化铝,故n[Al(OH)3]=0.35mol-0.15mol=0.2mol,根据电荷守恒计算;
Ⅱ.由H2O2→O2知,双氧水在反应中作还原剂,所以还必须有氧化剂参加反应,在反应中得电子化合价降低,根据化合价知,高锰酸根离子作氧化剂,还原产物是锰离子,同时反应后生成水,反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,结合离子方程式解答该题.
解答 解:Ⅰ.(1)D是具有氧化性的单质,A元素属于短周期主族金属元素,根据反应关系可知A为Na,B为Na2O,D为O2,C为Na2O2;若D为金属,由转化关系可知为变价金属,应为Fe,则C含有Fe2+,具有还原性,保存时应反之氧化,原理是2Fe3++Fe=3Fe2+,
故答案为:Na;加入少量铁,防止Fe2+被氧化为Fe3+:2Fe3++Fe=3Fe2+;
(2)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→AlO2-;A为Al3+;B为Al(OH)3;C为AlO2-;D为NaOH;或AlO2-→Al(OH)3→Al3+;A、AlO2-;B、Al(OH)3;C、Al3+;D为H+;B转化为C的所有可能的离子方程式为生成氢氧化铝沉淀,在酸或碱中溶解的离子方程式,反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O;
故答案为:Al(OH)3+3H+=Al3++3H2O、Al(OH)3+OH-=AlO2-+2H2O;
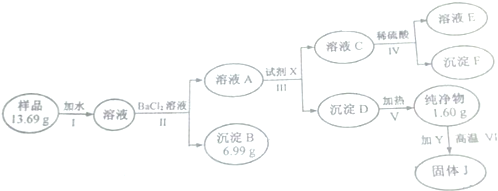
(3)合物Al(OH)3经过一系列反应可以得到单质E为Al,将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体,待反应完全后,向所得溶液中加入NaOH溶液,
由图可知,200~240mL为氢氧化铝与氢氧化钠反应,可知n[Mg(OH)2]=0.15mol,根据Mg元素守恒可知:m(Mg)=0.15mol×24g/mol=3.6g,
沉淀最大时为氢氧化镁、氢氧化铝,故n[Al(OH)3]=0.35mol-0.15mol=0.2mol,根据电荷守恒可知,20~200mL消耗氢氧化钠的物质的量等金属提供电子物质的量,故n(NaOH)=0.15mol×2+0.2mol×3=0.9mol,则c(NaOH)=$\frac{0.9mol}{0.2L-0.02L}$=5mol/L,
故答案为:3.6;5.0mol/L;
Ⅱ.反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
(4)反应中生成氧气,H2O2被氧化,为还原剂,MnO4-被还原生成Mn2+,故答案为:H2O2;MnO4-;Mn2+;
(5)高锰酸钾具有强氧化性,可氧化盐酸生成氯气,可应用硫酸酸化,故答案为:稀硫酸;
(6)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑反应中,Mn元素化合价由+7价降低到+2价,由方程式可知生成5mol氧气转移10mol电子,则如反应转移了0.6mo1电子,产生的氧气0.3mol,气体在标准状况下体积为0.3mol×22.4L/mol=6.72L,
故答案为:6.72.
点评 本题考查无机物推断,属于开放性题目,侧重于学生的分析、计算能力的考查,需要学生熟练掌握元素化合物知识,(3)中计算关键清楚个阶段发生的反应,注意利用守恒思想解答,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
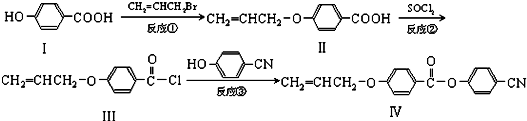
.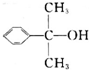 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是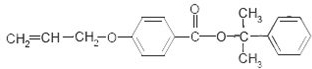 .
.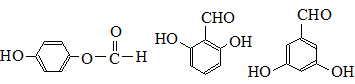 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
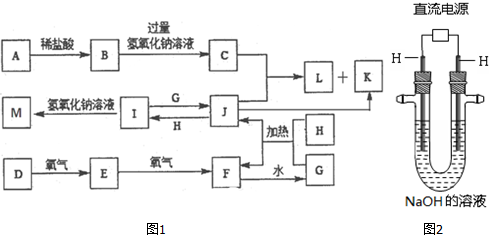
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
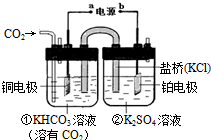
| A. | 该过程是电能转化为化学能的过程 | |
| B. | 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O | |
| C. | 一段时间后,②池中溶液的pH一定增大 | |
| D. | 盐桥中K+移向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 0.25mol | C. | 3.01×1023个 | D. | 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
有一支50 mL酸式滴定管中盛有盐酸,液面恰好在a mL刻度处,把管内液体全部放出,盛量筒内,所得液体体积一定是( )
A.a mL B.(50-a) mL C.大于(50-a) mL D.大于a mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com