
分析 (1)依据n=N/NA=m/M,结合二氧化硫中含有2个氧原子,三氧化硫中含有3个氧原子解答;
(2)标况下Vm=22.4L/mol,根据n=N/NA=V/Vm=m/M,分别计算出各物质的物质的量,然后分别计算出标准状况下的气体体积、含有原子的物质的量、含有氢原子的物质的量及质量,据此进行计算.
解答 解:(1)依据n=N/NA=m/M可知,含有相同分子个数的SO2和SO3,物质的量之比为:1:1;
依据n=m/M可知,相同物质的量的物质质量之比等于摩尔质量之比,所以物质的量之比为:1:1的SO2和SO3,质量之比为64:80=4:5;
二氧化硫中含有2个氧原子,三氧化硫中含有3个氧原子,则相同物质的量的SO2和SO3,其中所含氧原子个数比为2:3;
故答案为:4:5;1:1;2:3;
(2)①6.72LCH4中:n(CH4)=$\frac{6.72}{22.4}$mol=0.3mol,m(CH4)=0.3mol×16g/mol=4.8g,含有原子数的物质的量为:0.3mol×5=1.5mol,N(H)=4N(CH4)=1.2NH3;
②3.01×1023个HCl分子中:n(HCl)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$mol=0.5mol,V(HCl)=0.5mol×22.4L/mol=11.2L,含有原子的物质的量为0.5mol×2=1mol;
③13.6克H2S 中:n(H2S)=$\frac{13.6g}{34g/mol}$=0.4mol,V(H2S)=0.4mol×22.4L/mol=8.96L,含有原子的物质的量为:0.4mol×3=1.2mol,N(H)=2N(H2S)=0.8NA;
④0.2molNH3中:m(NH3)=0.2mol×17g/mol=3.4g,V(NH3)=0.2mol×22.4L/mol=4.48L,含有原子的物质的量为:0.2mol×4=0.8mol,N(H)=3N(NH3)=0.6NH3.
(1)根据分析可知,气体体积最大的是②,
故答案为:②;
(2)根据N=nNA可知,气体的物质的量越大,含有原子数越大,则含有原子数最多的为①,
故答案为:①;
(3)质量最小的是④,
故答案为:④;
(4)含氢原子数最少的是②,
故答案为:②.
点评 本题考查了以物质的量为核心的有关计算,明确以物质的量为核心的相关计算公式,熟悉物质的分子构成是解题关键,题目难度不大.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50g | B. | 60mol/g | C. | 60g/mol | D. | 50g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
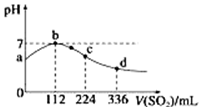 标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )| A. | b点水的电离程度比c点水的电离程度大 | |
| B. | 氢硫酸的酸性比亚硫酸的酸性强 | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol•L-1 | |
| D. | a点对应溶液的导电性比d点强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/LCaCl2溶液中含Cl-数为0.4NA | |
| B. | 标准状况下,1.12L H2S气体分子中含0.5NA个质子 | |
| C. | 常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子 | |
| D. | 标准状况下,4.48L的水中含有H2O分子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:K+、Ba2+、NO3-、Cl- | |
| B. | 0.1mol/LNaAlO2溶液:H+、Na+、Cl-、SO42- | |
| C. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| D. | 中性溶液:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置精炼铜,则b极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 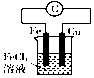 装置的总反应是Cu+2Fe3+=Cu2++2Fe2+ | |
| C. |  装置中钢闸门应与外接电源的负极相连 | |
| D. | 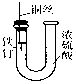 装置中的铁钉浸入浓硫酸中几乎没被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com