
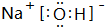 ,故答案为:
,故答案为: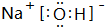 ;
;| 1mol×32g/mol |
| 1g |


科目:高中化学 来源: 题型:
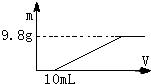 过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )
过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )| A、0.05mol |
| B、0.1mol |
| C、0.2mol |
| D、0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+H++Ba2++OH-=BaSO4↓+H2O |
| B、少量小苏打溶液滴入Ba(OH)2溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、碳酸氢根离子发生电离:HCO3-+H2O?H3O++CO32- |
| D、将1mol?L-1 NaAlO2溶液和1.5mol?L-1 HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 |  |  |  | |
| 添加试剂 | 10.0mL FeSO4溶液 | 10.0mL FeSO4溶液+2mL煤油 | 10.0mL FeSO4溶液+1.0g铁粉 | 10.0mL FeSO4溶液+ |
| 3天内的现象 | / | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=1的溶液中,Cu2+、Fe2+、NO3-和SO42-能大量共存 |
| B、用惰性电极电解饱和氯化钠溶液的离子方程式:2Cl-+2H+=H2↑+Cl2↑ |
| C、镁铝合金被碱液腐蚀时,负极反应式为:Mg-2e-=Mg2+ |
| D、检验某未知溶液中是否含SO42-时,应先加盐酸酸化,再加BaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com