
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____.
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____,B原子的杂化轨道类型是_____.
Li、B、H元素的电负性由大到小排列顺序为_____.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol﹣1 | I2/kJmol﹣1 | I3/kJmol﹣1 | I4/kJmol﹣1 | I5/kJmol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____,NaH的理论密度是___________gcm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
【答案】M 9 正四面体 sp3 H>B>Li < Mg 142pm ![]()
【解析】
(1)①Cl原子核外电子数为17,基态原子核外电子排布为1s22s22p63s23p5,据此解答;
②根据价层电子对互斥理论确定离子空间构型、B原子的杂化轨道类型;元素的非金属性越强,其电负性越大;
(2)①核外电子排布相同的离子,核电荷数越大,离子半径越小;
②该元素的第III电离能剧增,则该元素属于第IIA族;
(3)NaH具有NaCl型晶体结构,食盐晶体里Na+和Cl﹣的间距为棱长的一半,据此分析解答。
(1)①基态Cl原子中电子占据的最高能层为第3能层,符号M,该能层有1个s轨道、3个p轨道、5个d轨道,共有9 个原子轨道,
故答案为M;9;
②BH4﹣中B原子价层电子数=4+![]() =4,B原子的杂化轨道类型是sp3杂化,且不含孤电子对,所以是正四面体构型,非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
=4,B原子的杂化轨道类型是sp3杂化,且不含孤电子对,所以是正四面体构型,非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为正四面体;sp3;H>B>Li;
(2)①核外电子排布相同,核电荷数越大,离子半径越小,锂的质子数为3,氢的质子数为1,Li+、H﹣核外电子数都为2,所以半径Li+<H﹣,
故答案为<;
②该元素的第III电离能剧增,则该元素属于第IIA族,为Mg元素,
故答案为Mg;
(3)NaH具有NaCl型晶体结构,NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为![]() =142pm,该晶胞中钠离子个数=8×
=142pm,该晶胞中钠离子个数=8×![]() +6×
+6×![]() =4,氢离子个数=12×
=4,氢离子个数=12×![]() +1=4,NaH的理论密度是ρ=
+1=4,NaH的理论密度是ρ=![]()
![]()
,
故答案为142pm;![]() 。
。


科目:高中化学 来源: 题型:
【题目】按要求写出下列物质的结构简式:
(1)写出与环辛四烯![]() 互为同分异构体且属于芳香烃的分子的结构简式:___。
互为同分异构体且属于芳香烃的分子的结构简式:___。
(2)写出与苯互为同系物且一氯代物只有一种的物质的结构简式(仅写两种支链数不同且支链 数小于4的物质):___、___。
(3)某烷烃A蒸气的密度是相同状况下氢气密度的64倍,经测定得知A分子中共含有6个甲基。
①若A不可能是氢气与烯烃加成的产物,A的结构简式为___;
②若A是炔烃与氢气加成的产物,A的结构简式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向l0mL0.1mol/L的HR溶液中逐渐滴入0.lmol/L的NH3·H2O 溶液,所得溶液pH及导电性变化如图。下列分析不正确的是

A. ab点导电能力增强,说明HR为弱酸
B. b点溶液,c(NH3H2O)=c(R-)+c(H+)-c(OH-)
C. c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 常温下,HR和NH3H2O的电离平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:6g碳不完全燃烧所得产物中,CO与CO2的体积比为2∶3,且:C(s)+O2(g)=CO(g) ΔH=-110.35kJ·mol-1 CO(g)+O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1。与6g碳完全燃烧相比,损失的热量为( )
A.56.51kJB.110.35kJC.196.46kJD.282.57kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡唑类化合物是重要的医用中间体,如图是吡唑类物质L的合成路线。
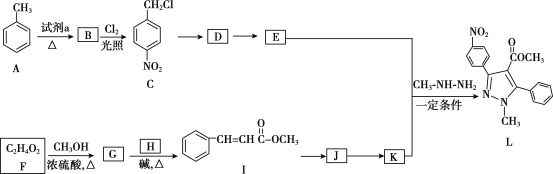
已知:R1—CHO+R2CH2—COOR3![]()
R1—CHO+R2NH2![]() R1—CH=N—R2
R1—CH=N—R2
(1)试剂a是__。
(2)C生成D的反应类型是__。
(3)D生成E的化学方程式是___。
(4)生成G的化学方程式是__。
(5)H的结构简式是__。
(6)写出符合下列条件的I的同分异构体的结构简式__。
a.是反式结构
b.能发生银镜反应
c.苯环上的一氯代物有2种
d.1mol该有机物能与2mol氢氧化钠反应
(7)K的分子式是C10H8O2,K的结构简式是__。
(8)以2-甲基丙烯和乙酸为原料,选用必要的无机试剂,合成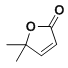 ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+) ______ ![]() 填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
(2)如图是0.1mol/L电解质溶液的pH随温度变化的图象:
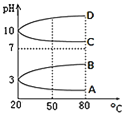
①其中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是 ______ (填写字母);
②20℃时,0.1mol/L NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______mol/L
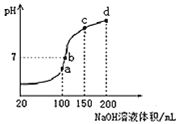
(3)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ______ ;在b点,溶液中各离子浓度由大到小的排列顺序是 ______
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)当溶液pH=5时,某溶液中的Al3+ ______ ![]() 填“能”或“不能”
填“能”或“不能”![]() 完全沉淀(溶液中的离子浓度小于1×10-5mol/L时,沉淀完全)
完全沉淀(溶液中的离子浓度小于1×10-5mol/L时,沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在“
时,在“![]() ”的水溶液体系中,
”的水溶液体系中,![]() ,
,![]() 和
和![]() 三者中各自所占的物质的量分数
三者中各自所占的物质的量分数![]() 随溶液pH变化的关系如图所示。下列说法正确的是
随溶液pH变化的关系如图所示。下列说法正确的是
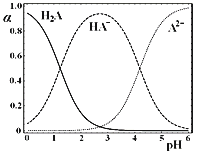
A.在含![]() A、
A、![]() 和
和![]() 的溶液中,加入少量NaOH固体,
的溶液中,加入少量NaOH固体,![]() 一定增大
一定增大
B.将等物质的量的NaHA和![]() 混合物溶于水,所得溶液中
混合物溶于水,所得溶液中![]()
C.NaHA溶液中,![]() 的水解能力大于
的水解能力大于![]() 的电离能力
的电离能力
D.在含![]() A、
A、![]() 和
和![]() 的溶液中,若
的溶液中,若![]() ,则
,则![]() 与
与![]() 不一定相等
不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是( )
)的说法正确的是( )
A.a、b、c的分子式均为C8H8
B.a、b、c中只有a的所有原子可能处于同一平面
C.a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
D.a、b、c均能与溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸加热反应制取乙烯,请回答下列问题:
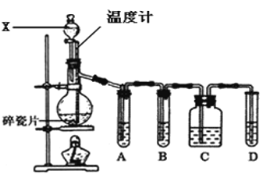
(1)写出实验室制乙烯的化学反应方程式:___,该反应中浓硫酸的作用是:___,___。
(2)有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题:
①图中A、B、C、D4个装置可盛放的试剂是A___,B___,C___,D__(将下列有关试剂的名称填入空格内)。
(1)品红溶液 (2)NaOH溶液 (3)KMnO4溶液
②能说明二氧化硫气体存在的现象是___。
③使用装置B的目的是___。
④使用装置C的目的是___。
⑤能证明含有乙烯的现象是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com