
反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g)在2 L密闭容器中进行1 分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
A.NO:0.001mol·L-1
B.H2O:0.002mol·L-1
C.NH3:0.002mol·L-1
D.O2:0.0025mol·L-1
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
在下列变化中,①I2的升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水,未发生化学键破坏的是________;仅发生离子键破坏的是________;仅发生共价键破坏的是________;既发生共价键破坏又发生离子键破坏的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学学习中,推理是一种重要的学习方法,下列推论正确的
是( )
A.由“BF3和SO3互为等电子体”,可推知二者均为非极性分子
B.由“某过程发生化学键断裂”,可推知该过程发生了化学变化
C.由“蒸干NaCl溶液得NaCl固体”,可推知蒸干MgCl2溶液得MgCl2固体
D.由“同温度下等浓度的Na2CO3溶液比Na2SO3溶液的pH大”,可推知C比S的非金属性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol·L-1NaOH溶液450 mL和
0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。

(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为_________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 __0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度 0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
_______mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为________、________和________。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有________、________。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是________。此化合物在酸性条件下与高锰酸钾反应的离子方程式为__________________;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2A(g)+3B(g)4C(g)+D(g),已知起始浓度c(A)=4mol·L-1,c(B)=3mol·L-1,C、D浓度均等于0,反应开始2秒后达到平衡状态,此时D的平衡浓度为0.5mol·L-1,则下列说法不正确的是( )
A.反应速率v(C)=1mol·L-1·s-1
B.C的平衡浓度为4mol·L-1
C.A的转化率为25%
D.B的平衡浓度为1.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个1 L的密闭容器中,加入2mol A和1mol B,发生下列反应:2A(g)+B(g)3C(g)+D(s),达到平衡时,C的浓度为1.2mol·L-1。
(1)维持容器的温度不变,若缩小容器的体积,则平衡________
移动(填“向正反应方向”或“向逆反应方向”或“不”)。
(2)维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2mol·L-1的是__________。
A.4mol A+2mol B
B.3mol C+1mol D
C.2mol A+1mol B+1mol D
(3)若维持容器内的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol·L-1,则C的起始物质的量应满足的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示某反应:
N2(g)+3H2(g)2NH3(g) ΔH=-a kJ·mol-1(a>0)在某一时间段t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )

A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
查看答案和解析>>
科目:高中化学 来源: 题型:
3对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:

已知:HCHO+CH3CHO CH2===CHCHO+H2O
CH2===CHCHO+H2O
(1)遇FeCl3溶 液显紫色且苯环上有两个取代基的A的同分异构体有________种。B中含氧官能团的名称为________。
液显紫色且苯环上有两个取代基的A的同分异构体有________种。B中含氧官能团的名称为________。
(2)试剂C可选用下列中的________。
a.溴水 b.银氨溶液
c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(3) 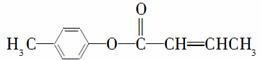 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为_________________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为_________________________。
(4)E在一定条件下可以生成高聚物F,F的结构简式为
________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com