
【题目】化学与生活、生产密切相关,下列有关说法正确的是( )
A.淀粉、纤维素、蛋白质都是高分子化合物,都能发生水解反应
B.合成不粘锅涂层的原料CF2=CF2属于烃
C.葡萄糖是常见的单糖,它不能发生银镜反应
D.石油裂解和煤的干馏都是物理变化
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】已知还原性I->Fe2+>I2,在水溶液中I2可被Cl2氧化为IO![]() 。向含溶质a mol的FeI2溶液中通入b mol Cl2,充分反应(不考虑单质与水的反应)。下列说法不正确的是( )
。向含溶质a mol的FeI2溶液中通入b mol Cl2,充分反应(不考虑单质与水的反应)。下列说法不正确的是( )
A. 当a=2b时,反应后的离子浓度之比c(Fe2+)∶c(I-)∶c(Cl-)=1∶1∶1
B. 当3a=2b时,发生的离子反应:2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-
C. 当13a=2b时,发生的离子反应为2Fe2++4I-+13Cl2+12H2O===4IO![]() +26Cl-+2Fe3++24H+
+26Cl-+2Fe3++24H+
D. 若反应后溶液中I2与IO![]() 的物质的量之比为1∶1,则反应中转移电子3.5b mol
的物质的量之比为1∶1,则反应中转移电子3.5b mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 人类目前所直接利用的能量全部是由化学反应产生的
B. 化学反应不一定伴随着能量变化
C. 化学变化中的能量变化主要是由化学键变化引起的
D. 化学反应中能量变化的大小与反应物质量的多少无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学探究小组同学为探究乙酸乙酯的制备与水解情况,甲、乙同学分别使用图1、图2装置制备乙酸乙酯。

已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。②相关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77 |
(1)甲同学在制得乙酸乙酯后,分离乙酸乙酯与饱和碳酸钠溶液的操作是_______________。
(2)试管中装有饱和Na2CO3溶液,其作用是________(填序号)。
A.吸收乙醇 B.除去乙酸
C.乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)甲同学分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出______________;再加入____________(填序号);然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,乙同学利用图2所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管B,再测有机层的厚度,实验记录如下:

①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol·L-1。
②分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )。
A. 每一周期的元素都是从碱金属开始,最后以稀有气体结束
B. 同一周期中(除第一周期外),从左到右,各元素原子核外电子数都是从1逐渐增加到8
C. 第二、三周期上下相邻元素的原子核外电子数相差8
D. 第七周期排满后只有23种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
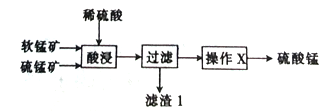
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1;H2CO3的电离常数Ka1=4.2×10-7mol·L-1、Ka2=5.6×10-11mol·L-1。
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因________________。
②常温下,物质的量浓度相同的下列四种溶液:a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液。其pH由大到小的顺序是:_____(填序号)。
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是_______;该醋酸溶液稀释过程中,下列各量一定变小的是______________。

a.c(H+) b.c(OH-)
c.![]() d.
d.![]()
(3)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=___________mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定,请回答下列问题:

(1)做1次完整的中和热测定实验,温度计至少需使用 次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?
。
(2)实验室用50 mL 0.50 mol·L-1盐酸,50 mL 0.55 mol·L-1 NaOH溶液进行测定中和热的实验,为了把测量数据记录下来,请你设计表格。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4分子中的4个H被苯基取代后的分子结构如右图所示,则关于该有机物的下列说法正确的是( )

A. 该有机物分子式为C25H24
B. 该多环芳烃属于稠环芳烃
C. 该分子中所有碳原子不可能处于同一平面
D. 该有机物能使酸性高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com