
 物质A和B混合时会发生放热反应.将等物质的量的浓度的A和B溶液,以不同的体积比混合,但总体积始终保持100mL.混合后体系的最高温度如图所示,则A、B两种物质反应时其物质的量的之比是( )
物质A和B混合时会发生放热反应.将等物质的量的浓度的A和B溶液,以不同的体积比混合,但总体积始终保持100mL.混合后体系的最高温度如图所示,则A、B两种物质反应时其物质的量的之比是( )| A. | 1:3 | B. | 3:2 | C. | 3:1 | D. | 4:1 |
分析 物质A和B混合时会发生放热反应,反应过程中放出的热量使混合液温度升高;根据图象可知,加入60mL和80mLA溶液时混合液温度相同,说明而在恰好反应时A溶液体积大于60mL小于80mL,据此进行解答.
解答 解:根据图示可知,A、B溶液体积分别为0时,溶液温度为20℃,说明A、B两溶液的温度均为20℃,
随着A溶液体积增大,反应后溶液温度逐渐升高,当加入60mLA溶液时温度达到最高(30℃),由于两溶液浓度相同,则此时溶质A、B物质的量之比为60mL:(100-60)mL=3:2;
当加入80mLA溶液时,反应温度仍然为30℃,由于混合液体积增大,而溶液温度不变,说明在加入60mL=80mLA溶液过程中会继续放出热量,此时A、B的物质的量之比为:80mL:(100-80)mL=4:1,
根据分析可知,A、B恰好反应时而在的物质的量之比应该介于3:2~4:1之间,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确A、B恰好反应的点在60mL到80mL之间为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸的浓度不变,其用量增加一倍 | |
| B. | 盐酸的浓度增加一倍,其用量减少一半 | |
| C. | 使反应在较高的温度下进行 | |
| D. | 盐酸的浓度不变,使块状大理石变成粉末状 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使含NH4+的溶液放出NH3的溶液:Na+、Mg2+、SO42-、Cl- | |
| B. | 1.0mol•L-1的NaNO3的溶液:H+、Cu2+、I-、SO42- | |
| C. | $\frac{{K}_{W}}{c({OH}^{-})}$=0.001mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| D. | FeCl3溶液:NH4+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
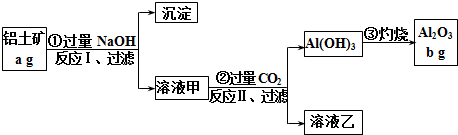
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
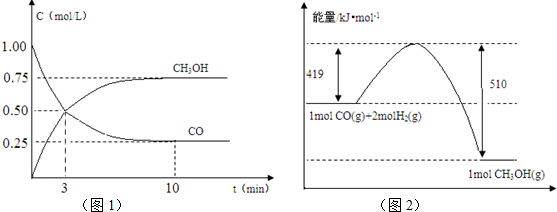
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | Cl-Cl | H-Cl |
| E (kJ •mol-1) | 436 | 243 | 432 |
| A. | H2(g)+Cl2(g)=2HCl (g)△H=+247 kJ•mol-1 | |
| B. | H (g)+Cl (g)→HCl (g)△△H=+432 kJ•mol-1 | |
| C. | 1 mol H2(g) 与1 mol Cl2(g) 的总能量高于2 mol HCl (g) 的总能量 | |
| D. | 用电子式表示HCl的形成过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com