
 2NH3 + Q,下列叙述中正确的
2NH3 + Q,下列叙述中正确的 | A.反应物和生成物的浓度相等 | B.反应物和生成物的浓度不再变化 |
| C.降低温度,平衡混合物中NH3的浓度减小 | D.增大压强,不利于氨的合成 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
A.V(A)=
| B.V(B)=
| C.V(C)=4V(B) | D.V(D)=
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3,下列判断正确的是
2SO3,下列判断正确的是| A.2 mol SO2和足量的O2反应,一定生成2mol SO3 |
| B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2 |
| C.平衡时SO2的消耗速率等于O2的生成速率的2倍 |
| D.平衡时SO2的浓度为O2浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钢铁在潮湿的空气中比在干燥空气中更容易生锈 |
| B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 |
| C.蒸馏水和0.1 mol?L-1 NaOH溶液中的c(H+),前者大于后者 |
| D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO2(g) ΔH="+57.20kJ" · mol-1
2NO2(g) ΔH="+57.20kJ" · mol-1| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4) /mol··L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2) /mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g),SO2和O2起始时分别为20mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起起始时SO3的物质的量及其转化率为
2SO3(g),SO2和O2起始时分别为20mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起起始时SO3的物质的量及其转化率为| A.10 mol和 10% | B.20 mol和 80% | C.20 mol和 40% | D.20 mol和 20% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
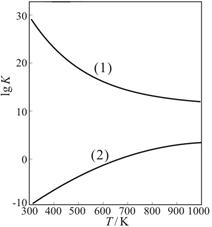
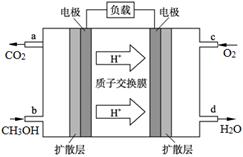
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
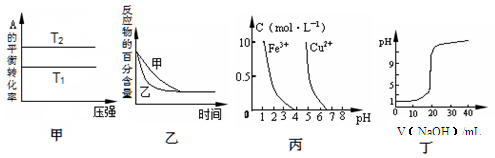
A.由图甲可以判断:对于反应aA(g)+ bB(g) cC(g),若T1>T2, 则a +b=c且 ?H<0 cC(g),若T1>T2, 则a +b=c且 ?H<0 |
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1000 mol/L NaOH溶液滴定20.00 mL0.1000 mol/L醋酸溶液得到的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等压时,通入惰性气体,c的物质的量不变 |
| B.等压时,通入z气体,反应器中温度升高 |
| C.等容时,通入惰性气体,各反应速率不变 |
| D.等容时,通入z气体,y的物质的量浓度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com