
| A. | 三种物质质子数之比为1:2:3 | B. | 三种物质中子数之比为1:1:1 | ||
| C. | 三种物质的摩尔质量之比为8:9:10 | D. | 三种物质的化学性质不同 |
分析 Li的质子数为3,H、D、T指氢的同位素11H、12H、13H,H、D、T的质子数都是1,中子数分别为0、1、2,质量数=质子数+中子数,质量数之比等于摩尔质量之比,利用组成和结构来分析物质的化学性质.
解答 解:Li的质子数为3,H、D、T指氢的同位素11H、12H、13H,H、D、T的质子数都是1,中子数分别为0、1、2.
A.LiH、LiD、LiT的质子数之比为(3+1):(3+1):(3+1)=1:1:1,故A错误;
B.LiH、LiD、LiT的中子数之比为(4+0):(4+1):(4+2)=4:5:6,故B错误;
C.LiH、LiD、LiT的摩尔质量之比为(7+1):(7+2):(7+3)=8:9:10,故C正确;
D.LiH、LiD、LiT的组成元素相同,结构相同,则三种物质的化学性质相同,故D错误;
故选C.
点评 本题考查原子的构成、物质的组成及原子中的数量关系,选项C、D都是解答中的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①③④⑤ | C. | ②⑥⑦⑧ | D. | ⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的电子层数呈周期性变化 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
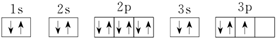
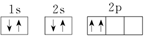
| A. | ①③⑥ | B. | ②④⑦ | C. | ③④⑥ | D. | ③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③② | B. | ①②③ | C. | ②③① | D. | ②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com