
| A、推广燃煤脱硫技术,可以防治SO2污染 | B、陶瓷、玻璃、水泥等是使用量最大的无机非金属材料 | C、二氧化硫具有漂白性,可以用来漂白食品 | D、Fe2O3俗称铁红,常用作红色油漆和涂料 |


科目:高中化学 来源: 题型:阅读理解

| ||
| 高温 |
| ||
| 高温 |
| 4 |
| 7 |
| ||
| 高温 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源:2015届河南省焦作市高一下学期期末测试化学试卷(解析版) 题型:推断题
由五种短周期主族元素组成的单质及化合物(或其溶液),它们的转化关系如下图所示。其中,A、B、C、D、E为单质,常温下A为固体,B、C、D、E为气体;G的焰色反应为黄色;D和E的反应在工农业生产中有重要的意义;K为G和I反应的产物之一。
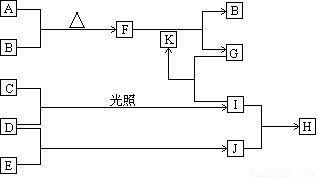
(1)写出五种单质的名称
(2)I、J相遇反应生成H,反应的现象是 ,化学反应方程式为 ,H物质的电子式为
(3)F的颜色为 ,F和K反应的化学方程式为 。
(4)G和H也可以发生反应,若G和H恰好完全反应,则A、B、C、D、E的物质的量之比为 。
(5)D和E的反应是典型的可逆反应,并且是放热反应。该反应的化学方程式为
请用某两种物质的反应速率间的等量关系表明该反应已经达到化学平衡,该等量关系可以是 ;反应物的总能量E反与生成物的总能量E生的大小关系是:E反 E生。
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题
 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题 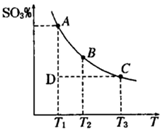
 2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”) 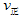 _____
_____ (填“>”“<”或“=”)
(填“>”“<”或“=”)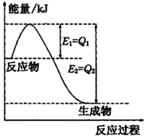

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
(1)硫酸生产中,SO2催化氧化生成SO3;
 2SO2(g)+O2(g)
2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
①2SO2(g)+O2(g)![]() 2SO3(g)的△H 0(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通人氦气,平衡 移动(填“向左” 或“向右”)
2SO3(g)的△H 0(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通人氦气,平衡 移动(填“向左” 或“向右”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;反应进行到状态D时,![]()
![]() (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
①如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:
(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水,在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=“);用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数 .
(3)海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。已知25℃时KSP(AgCl)=1.6×l0-10 mol2·L-2 KSP(AgI)=1.5×l0-16 mol2·L-2 。在25℃下,向0.1L 0.002mol·L-l的NaCl溶液中加入0.1L 0.002mol·L-l硝酸银溶液,有白色沉淀生成,从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com