
| A、把两种溶液快速混合并不断搅拌 | B、把两种溶液缓慢混合并不断搅拌 | C、把H2SO4溶液滴加到Na2CO3溶液中 | D、把Na2CO3溶液滴加到H2SO4溶液中 |


科目:高中化学 来源: 题型:阅读理解
| 通电 |
| 加热 |
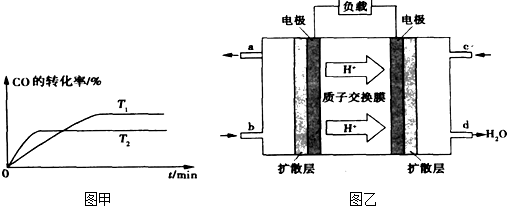
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
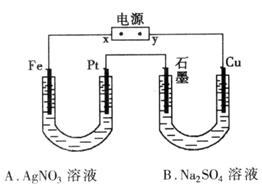
①电源x极为____________极
②B池中阳极电极反应试是_______________________________。
③标况时,如果A中共收集到0.56L气体,则A池中的pH为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有1.5mL 2mol?L-1的H2SO4溶液与15mL 3 mol?L-1的Na2CO3溶液,欲使其反应产生CO2的量最多,则正确的操作是
A.把两种溶液快速混合并不断搅拌 B.把两种溶液缓慢混合并不断搅拌
C.把NaCO3溶液滴加到H2SO4溶液中 D.把H2SO4溶液滴加到Na2CO3溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com