
| A.H2O2和Na2O2都属于氧化物,两种物质中所含的化学键类型完全相同 |
| B.原子核外在离核较远区域的电子易失去,其原因是这些电子能量较高 |
| C.第三周期非金属元素形成氢化物的稳定性从左到右逐渐增强 |
| D.在周期表的金属元素和非金属元素的交界处寻找半导体,在过渡元素区中寻找催化剂 |
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4+中质子数和电子数相等 |
| B.乙醇比乙二醇的沸点低 |
| C.乙炔与苯的实验式均为CH |
| D.过氧化钠与过氧化氢中均含有非极性键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:rw>rz>ry>rx |
| B.元素Y的最简单气态氢化物的热稳定性比Z的强 |
| C.含X、Y、Z三种元素的化合物的水溶液一定显酸性 |
| D.化合物Y2X4能发生加成反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
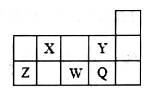
| A.元素的非金属性Y>Q,但其同浓度氢化物水溶液的酸性,HY<HQ |
| B.形成简单离子的半径从小到大的顺序是Y<Q<W |
| C.Z的最高价氧化物可溶于水,也能溶于强碱溶液 |
| D.X的气态氢化物浓溶液可用于检验管道氯气的泄漏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
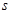 键与π键的键数之比为 。
键与π键的键数之比为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com