
分析 原子序数 11~17 的元素,自钠到氯,电子层数相同,最外层电子数从1到7;随着原子序数的递增,原子半径减小,核电荷数增大,核对最外层电子的引力增强,失电子能力减弱,得电子能力增强,则金属性减弱,非金属性增强,以此来解答.
解答 解:原子序数 11~17 的元素,自钠到氯都位于第三周期,电子层数相同,最外层电子数从1增大到7;随着核电荷数依次递增,原子半径依次减小,得到电子能力逐渐增强,因此金属性逐渐减弱,非金属性逐渐增强,
故答案为:1;7;减小;增强;减弱;增强.
点评 本题考查同周期元素的性质,为高频考点,题目难度不大,把握同周期元素性质的变化规律为解答的关键,注重基础知识的考查,属于记忆性知识点,试题有利于提高学生的灵活应用能力.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,32g三氧化硫的体积约为11.2L | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性 HClO4>HNO3>H3PO4>H2SiO3 | B. | 稳定性H2S>HCl>HBr>HI | ||
| C. | 熔点 Rb>K>Na>Li | D. | 溶解性NaHCO3>Na2CO3>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
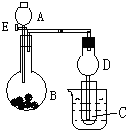 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com