
【题目】已知在1×103Pa、298K条件下,4g氢气燃烧生成水蒸汽放出484kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+![]() O2(g) △H=+242 kJ·mol-1
O2(g) △H=+242 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) △H=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(l) △H=-242 kJ·mol-1
O2(g)= H2O(l) △H=-242 kJ·mol-1
D.H2O(l)=2H2(g)+O2(g) △H=+484 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数值用NA表示。下列说法中不正确的是
A. 0.5 mol由F2与Ar组成的混合气体中含质子总数为9NA
B. 标准状况下,足量Na2O2与5.6 L CO2反应转移电子数目为0.25NA
C. 71g Cl2通入水中,HClO、ClO-、Cl-三种微粒数目之和为2NA
D. 常温下,1.5 L 1.0 mol L-1 CuSO4溶液中阳离子数目大于1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2 L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )

A.反应前10 min内反应的平均速率为v(D)=0.3 mol·L-1·min-1
B.若平衡时保持温度不变,压缩容器体积,平衡逆向移动,平衡常数K值减小
C.反应至15 min时,其他条件不变,改变的条件可能是缩小容器体积
D.反应至15 min时,其他条件不变,改变的条件可能是降低反应体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe2O3、Al2O3、FeO、SiO2)制备绿矾(FeSO47H2O)的流程如下:

已知:①FeS2难溶于水,能还原Fe3+,硫元素被氧化成SO42-。
②金属离子生成氢氧化物沉淀的pH范围见下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.5 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 6.3 | 8.3 |
(1)滤渣Ⅰ的主要成分可与某种酸反应,其气态产物的电子式为____________;滤渣Ⅱ经灼烧后可用于_______(写出一种用途即可)。
(2)“还原”的目的是__________,写出“还原”步骤中涉及反应的离子方程式_________。
(3)“除铝”反应过程中控制的pH范围是_______________________。
(4)操作Ⅲ包含3个基本的实验操作,依次是_______________,“洗涤”时的试剂最好选用下列中的____________(填代号)
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有Fe3+:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如图:
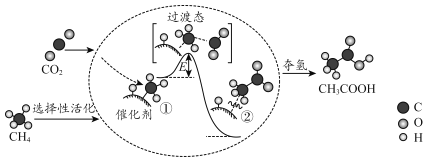
下列说法不正确的是( )
A.①→②放出能量
B.①→②中形成碳碳键
C.①→②中碳氢键发生断裂
D.由②得到乙酸的过程中,形成了氧氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式为:
①H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ·mol-1
O2(g)=H2O(l) △H=-285.8 kJ·mol-1
②H2(g)=H2(l) △H=-0.92 kJ·mol-1
③O2(g)=O2(l) △H=-6.84 kJ·mol-1
④H2O(l)=H2O(g) △H=+44.0kJ·mol-1
则反应H2(l)+![]() O2(l)=H2O(g)的反应热△H与△H1、△H2、△H3、△H4的关系正确的是为
O2(l)=H2O(g)的反应热△H与△H1、△H2、△H3、△H4的关系正确的是为
A.△H=△H1+△H2+△H3+△H4
B.△H=△H1-△H2-△H3+△H4
C.△H=△H1+△H2+![]() △H3+△H4
△H3+△H4
D.△H=△H1-△H2-![]() △H3+△H4
△H3+△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
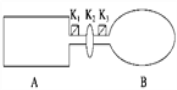
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究氨气的性质。

(1)实验室用氯化铵和氢氧化钙共热制取氨气,该反应的化学方程式是__。
(2)①中湿润的红色石蕊试纸变为__色。
(3)向②中滴入浓盐酸,现象是___。
(4)甲、乙、丙三位同学设计的制取氨气的装置,

采用上述装置,用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为哪位同学能够达到实验目的__(填“甲”、“乙”或“丙”)。他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为__(填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某只含C、H、O三种元素的有机物分子的球棍模型。关于该物质的说法正确的是
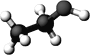
A.分子式为CH3COOH
B.能用于萃取碘水中的单质碘
C.能使紫色石蕊试液变红色
D.能与金属钠反应生成氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com