
【题目】为探究铁和硫反应产物中铁的化合价,某同学设计了如下所示的实验过程:
![]()
已知:①铁和硫反应产物不溶于碱,能溶于硫酸
②硫可溶于热碱溶液,发生类似于 Cl2 和 NaOH 溶液的化学反应下列说法不正确的是
A.混合粉末应在 N2 氛围中进行加热,所用 H2SO4 溶液应先煮沸
B.取溶液 A,滴加 KSCN 溶液,未出现红色,可证明铁和硫反应只有+2 价铁生成
C.滤渣用稀 H2SO4 溶解时应在通风橱中进行
D.硫溶于热碱溶液可能发生的离子反应是3S+6OH-![]() 2S2-+SO32-+3H2O
2S2-+SO32-+3H2O
【答案】B
【解析】
探究铁和硫反应产物实验流程:为防止Fe和S被氧气氧化,铁粉和硫粉在惰性气体环境中反应生成硫化亚铁,S粉必须要过量,保证铁粉完全反应,避免过量的铁粉与硫酸反应生成Fe2+而干扰实验,在黑色固体中加入热的氢氧化钾溶液,发生反应:3S+6KOH![]() 2K2S+K2SO3+3H2O,除去混合物中过量的硫粉,将稀硫酸煮沸防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验。
2K2S+K2SO3+3H2O,除去混合物中过量的硫粉,将稀硫酸煮沸防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验。
A.为防止Fe和S被氧气氧化,铁粉和硫粉在惰性气体环境中反应生成硫化亚铁,将稀硫酸煮沸防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验,故A正确;
B.题中末说明硫粉是否过量,可能发生Fe+2Fe3+=3Fe2+,取溶液 A,滴加 KSCN 溶液,未出现红色,不能证明铁和硫反应只有+2 价铁生成,故B错误;
C.滤渣FeS用稀 H2SO4 溶解时会产生H2S,有毒,应在通风橱中进行,故C正确;
D.硫溶于热碱溶液可能发生3S+6KOH![]() 2K2S+K2SO3+3H2O,离子反应是3S+6OH-
2K2S+K2SO3+3H2O,离子反应是3S+6OH-![]() 2S2-+SO32-+3H2O,故D正确;
2S2-+SO32-+3H2O,故D正确;
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题
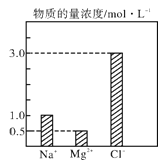
(1)该混合液中,NaCl的物质的量为_________mol,含溶质MgCl2的质量为_______g。
(2)该混合液中CaCl2的物质的量为___________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为__________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)。
已知:CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol-1
则反应2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)ΔH=________。
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解200 mL饱和食盐水(惰性电极),一段时间后,阴极收集到标况下的氢气2.24 L(设电解后溶液体积不变)。
①二甲醚燃料电池的正极反应式为:___________,负极反应式为:_____________。
②请写出电解食盐水的化学方程式:____________________。
③电解后溶液的c(OH-)=________,理论上消耗二甲醚的质量为________(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
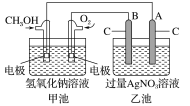
【题目】据报道,某种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用较长时间。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O。
2K2CO3+6H2O。
请填空:
(1)充电时,①燃料电池的负极与电源________极相连。
②阳极的电极反应式为:________________________。
(2)放电时:负极的电极反应式为:__________________。
(3)在此过程中若完全反应,乙池中A极的质量增加648 g,则甲池中理论上消耗O2____________L(标准状况)。
(4)若在常温常压下,1 g CH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molNaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后,对所得固体进行测定,发现Na2O2无剩余,则所得固体的物质的量(n)为
A.1mol<n<2molB.1mol<n<4mol
C.2mol<n≤4molD.1mol<n≤4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) KClO3 在 673K 时可分解为固体 A 和固体 B(物质的量之比为 3∶1),其中固体 A 所含元素与 KClO3 完全相同。写出相应的化学反应方程式 ___。比较KClO3 和固体 A 的热稳定性:KClO3_______固体 A(填“>”、“<”或“=”)。
(2)NaCN 各原子均满足 8 电子稳定结构。写出 NaCN 的电子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-VOCl2电池是一种基于阴离子传导的新型二次电池,其简化装置示意图如下。总反应为Mg+2VOCl2![]() MgCl2+2VOCl,下列说法错误的是
MgCl2+2VOCl,下列说法错误的是

A.采用Mg作电极材料比Li的安全性更高
B.为该电池充电时Mg电极应与电源的正极相连
C.放电时正极反应为VOCl2+e-= VOCl+Cl-
D.放电过程中Cl-穿过复合离子液体向Mg移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24 L CHCl3 所含共价键数为0.4NA
B.常温常压下,2 g羟基(18OD)所含的中子数为NA
C.常温常压下,1.5 g NO与1.6 g O2充分反应后混合物中原子总数为0.2NA
D.常温下,2 L 0.1 molL-1FeCl3 溶液与1 L 0.2 molL-1FeCl3 溶液所含Fe3+数目相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com