
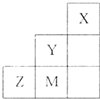
| A、气态氢化物稳定性为:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D、三种元素中,Y的非金属性最强,Y的最高价氧化物的水化物的酸性最强 |


科目:高中化学 来源: 题型:
| A、CaO+H2O=Ca(OH)2 | ||||
B、C+H2O(g)
| ||||
| C、2F2+2H2O=4HF+O2 | ||||
| D、3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | 第四次终点 | |
| 滴定管 液面刻度 | 0.00mL | 20.02mL | 21.00mL | 19.98mL | 20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
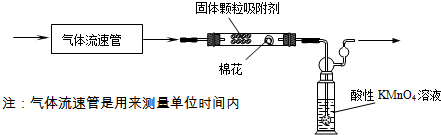
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色 |
| B、若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色 |
| C、若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 |
| D、若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com