
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)与N3-含有相同电子数的三原子分子的空间构型是 。
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因 。
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是__________,乙醛分子中H—C—O的键角__________乙醇分子中的H—C—O的键角(填“大于”、“等于”或“小于”)。
(4)Cu+的核外电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O 。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式 。
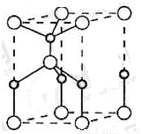
(6)Cu3N的晶胞结构下图所示:
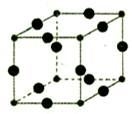
N3-的配位数为__________,Cu+半径为apm,N3-半径为b pm,Cu3N的密度__________g/cm3。(阿伏加德罗为常数用NA表示)
(1)V形
(2)Cu为金属晶体,晶体中存在可自由移动的电子,通电后定向移动。
(3)sp2 ,sp3;大于
(4)1s22s22p63s23p63d10 Cu+价电子为3d10为全充满结构更稳定
(5)

(6)6 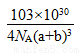
【解析】(1)N3-的电子数是10,与它相同的电子数,且三原子如H2O,应是V型分子;
(2)因为Cu为金属晶体,根据“电子气”理论,晶体中存在可自由移动的电子,通电后定向移动。
(3)乙醛的结构简式是CH3CHO,前边-CH3中C是sp3杂化,醛基-CHO中存在碳氧双键,其中的碳原子采取的是sp2杂化,键角是120°。乙醇中C原子采取的是sp3杂化,键角小于120°,所以键角的大小关系是乙醛大于乙醇。
(4)Cu+的核外电子排布式是1s22s22p63s23p63d10。CuO在高温下会分解成生成稳定的Cu2O,是因为Cu+价电子为3d10为全充满结构更稳定。
(5)[Cu(H2O)4]2+为平面正方形结构,所以其结构是

(6)观察晶胞的结构知中,顶点的N3-(1/8)对应的三条棱上有3个Cu+(1/4),故N3-:Cu+=1/8:3/4=1:6,其配位数是6。晶胞的体积是V=(2a+2b)3×10-30cm3,质量同206/NA,故密度为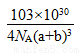 。
。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:2014高考名师推荐化学铜及其化合物主要性质、合金(解析版) 题型:填空题
铜单质及其化合物是应用极其广泛的物质。
(1)铜是氢后金属,不能与盐酸发生置换反应,但将单质铜置于浓氢碘酸中,会有可燃性气体及白色沉淀生成,又知氧化性:Cu2+>I2,则铜与氢碘酸反应的化学方程式为__________________________________
(2)已知Cu2O能溶于醋酸溶液或盐酸中,同时得到蓝色溶液和红色固体,则Cu2O与稀硫酸反应的离子方程式为____________________________________;
Cu2O与稀硝酸反应的离子方程式为_____________________________;
只用稀硫酸来确定某红色固体是 Cu2O与Cu组成的混合物的方法:称取m g该红色固体置于足量稀硫酸中,充分反应后过滤,然后___________________。
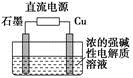
(3)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解装置如图所示,电解总反应:2Cu+H2O Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
(4)现向Cu、Cu2O、CuO组成的混合物中加入1 L 0.6 mol/L HNO3恰好使混合物溶解,同时收集到2 240 mL NO(标准状况)。若将上述混合物用足量的氢气还原,所得固体的质量为________;若混合物中含有0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗硫酸的物质的量为________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大
B.升高平衡体系的温度(保持体积不变),混合气体的密度不变
C.当反应达到平衡时,N2和H2的浓度比是1∶3
D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C B(选填“>”“<”),第一电离能N>O,原因是 。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为 ,其中硫原子采用 杂化,氧原子的价电子排布图为 ,任意写出一种SO42-等电子体 。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。
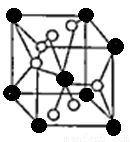
则该氧化物的化学式 (图中钛原子用“O”表示。氧原子用“O”表示)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下:
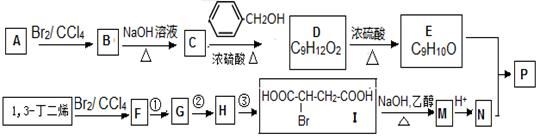
(1)B的名称为_____________,E中所含官能团的名称为 ;
(2)I由F经①~③合成,F可以使溴水褪色。
a.①的化学方程式是
b.②的反应试剂是
c.③的反应类型是
(3)下列说法正确的是
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol最多消耗3molNaOH
d.N不存在顺反异构体
(4)写出E与N按照物质的量之比为1:1发生共聚生成P的化学反应方程式 高聚物P的亲水性比由E形成的聚合物_____(填“强、弱”)。
(5)D的同系物K比D分子少一个碳原子,K 有多种同分异构体,符合下列条件的K的同分异构体有 种。写出其中核磁共振氢谱为1:2:2:2:3的一种同分异构体的结构简式 。
a.苯环上有两种等效氢
b.能与氢氧化钠溶液反应
c.一定条件下1mol该有机物与足量金属钠充分反应,生成1molH2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习2(解析版) 题型:填空题
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:
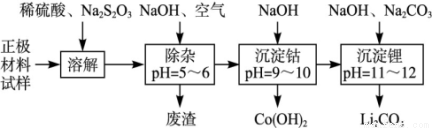
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为 ,还原产物是 。
(2)在上述除杂过程中,通入空气的作用是 废渣的主要成分是 。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为 。
(4)除了废渣可以回收利用外,本工艺还可回收的副产品是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
卤族元素包括F、Cl、Br等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 。
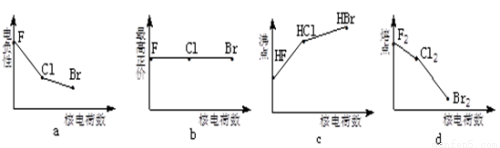
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 ,该功能陶瓷的化学式为 。
(3)BCl3和NCl3中心原子的杂化方式分别为 和 。第一电离能介于B、N之间的第二周期元素有 种。
(4)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学资源的综合应用(解析版) 题型:选择题
实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是
A.称取3g左右的干海带——托盘天平
B.灼烧干海带至完全变成灰烬——蒸发皿
C.过滤煮沸后的海带灰和水的混合物——漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘——分液漏斗
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子大量共存与推断(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32-
B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3-
D.K+、NH4+、OH-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com