
| △ |
| ||
| m |
| M |
| 11g |
| 44g/mol |


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
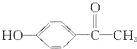 ,这是一种值得进一步研究应用的药物.
,这是一种值得进一步研究应用的药物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②④⑤ |
| C、①②⑤ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x+y<n |
| B、该化学平衡向右移动 |
| C、B的转化率增大 |
| D、C的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、只有③ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用小苏打治疗胃酸过多 HCO3-+H+═CO2↑+H2O |
| B、往碳酸镁中滴加稀盐酸 CO32-+2H+═CO2↑+H2O |
| C、氯气通入冷水中 Cl2+H2O═Cl-+ClO-+2H+ |
| D、氢氧化钡溶液与稀硫酸反应 Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在1L 0.1mol/L的NH4NO3溶液中含氮原子数目为0.2NA |
| B、标准状况下22.4 L CH3CH2OH中碳原子数为2NA |
| C、0.2 mol?L-1 NaHCO3溶液中含Na+数为0.2NA |
| D、标准状况下,22.4L Cl2与足量的铁粉完全反应转移电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com