
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.5.6g铁粉在0.1mol氯气中充分燃烧,转移电了数为0.3NA
B.7.8gNa2S和 Na2O2的固体混合物中含有的阴离子数大于0.1NA
C.50mL l8.4mol·L-1浓浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA
D.常温常压下,46gNO2和N2O4的混合物中含有2NA个氧原子
D
【解析】
试题分析:A、5.6g铁粉在0.1mol氯气中充分燃烧生成氯化铁,5.6g铁粉反应需要0.15mol氯气,所以氯气不足,根据氯气计算转移的电子数,所以反应转移电子数为0.1mol×2×NAmol-1=0.2NA,A错误;7.8gNa2S中含有的阴离子数为7.8/78×NAmol-1=NA,过氧化钠有钠离子和过氧根离子构成,7.8g Na2O2中含有的阴离子数为7.8/78×NAmol-1=NA,所以7.8gNa2S和 Na2O2的固体混合物中含有的阴离子数等于0.1NA,B错误;C、随着反应的进行,浓硫酸渐渐变成稀硫酸,就不再和铜发生反应,所以生成SO2分子的数目小于0.46NA,错误;D、NO2和N2O4的中N原子与O原子的个数比都为1:2,46gNO2和N2O4含有的氧原子总数为46/46×2NA=2NA,正确,选D。
考点:考查物质的量的计算。


科目:高中化学 来源:2015届山东省济宁市高三10月阶段测试化学试卷(解析版) 题型:选择题
北京2008奥运会金牌为金镶玉,直径为70mm,厚6mm。某化学兴趣小组对金牌中金属的成分提出猜想:甲认为该金属是由纯金制成;乙认为该金属是由金银合金制成;丙认为该金属是由黄铜(铜锌合金)制成。为了验证他们的猜想,取制造这种金牌的材质粉末少量进行实验,加入下面一种试剂来证明甲、乙、丙猜想的正误,该试剂应是( )
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:选择题
1 L某混合溶液中,溶质X、Y的浓度都为0.1 mol/L,向混合溶液中滴加某溶液Z(0.1 mol/L的氢氧化钠或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化关系如图所示,则X、Y、Z分别是
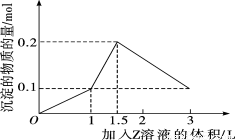
A.AlCl3、 FeCl3、 NaOH B.AlCl3、 MgCl2、 NaOH
C.NaAlO2、Ba(OH)2、H2SO4 D.NaAlO2、BaCl2、 H2SO4
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:填空题
铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,同答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。(填序号)
a.纯铁硬度比生铁高
b.纯铁耐腐蚀性强,不易生锈
c.不锈钢是铁合金,只含金属元素
d.铁在一定条件下,可与水蒸气反应
e.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为_____________ ,所形成该分散系的微粒范围是__________。
L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为_____________ ,所形成该分散系的微粒范围是__________。
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路极。请写出FeCl3溶液与铜反应的离子方程式___________ 。
(4)高铁酸钠(Na2FeO4)是一种新型净水剂。
①高铁酸钠在水中可以发生如下反应:4FeO4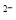 +10H2O=4Fe(OH)3+8OH
+10H2O=4Fe(OH)3+8OH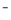 +3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________。
+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________。
②下列物质能用作净水剂的有___________。
a.KAl(SO4)2 l2H2O b.聚合硫酸铁
l2H2O b.聚合硫酸铁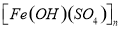
c.ClO2 d.“84”消毒液
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
等质量的下列物质与足量浓盐酸反应,放出Cl2物质的量最多的是
A.KMnO4 B.MnO2 C.NaClO3 D.NaClO
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下列有关实验的做法错误的是
A.用苯从溴水中提取溴,有机层从分液漏斗的上口倒出
B.实验室可以用浓氨水和生石灰制备NH3
C.实验室中用加热方法分离碘和食盐的混合物
D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
在恒容密闭容器中通入X并发生反应:2X(g) Y(g);
Y(g);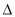 H=Q kJ·mol-1。温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
H=Q kJ·mol-1。温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
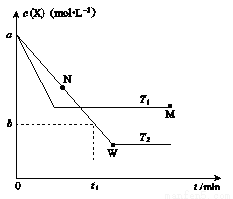
A.该反应进行到M点放出的热量于小进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=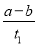 mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:填空题
(17分)按要求回答下列问题:
(1)实验室铝粉和Fe2O3作铝热反应实验,铝热反应的方程式为_________,该实验中除用到铝粉和Fe2O3外,需要的试剂还有 (填编号)。
a.KClO3 b.Mg c.MnO2 d.KCl
(2)据文献报道,在实际反应中铝热反应的产物成分较为复杂。某课题组对铝热反应产物的成分进行探究,经成分分析,发现主要得到甲和乙两种产物。甲由具有相同电子层结构的阴、阳离子构成;乙是一种铁铝的金属互化物(可用FexAly表示),取该合金粉末2.47g,滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体在空气中充分加热、灼烧得红棕色粉末1.60g。
①甲的化学式为______,乙中x=_____,y=_______。
②甲的晶体是耐高温材料,用此材料做成的坩埚,不能用来熔融NaOH,用化学方程式解释其原因______;含二氧化硅材料做成的坩埚_____(填“能”或“不能”)用来熔融NaOH。
③下图表示室温下相同组分的乙分别在两种不同的酸中的腐蚀情况,
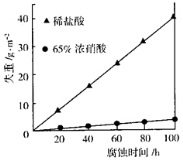
由图可知,乙在______中具有比较强的抗腐蚀性,原因可能是______。
④研究发现铝热反应后期温度高达2000℃以上时会有极微量的Al4C3生成,Al4C3遇水会产生一种气体,该气体的分子式为________。[已知CaC2+2H2O=Ca(OH)2+C2H2↑]
(3)镁铝互化物(Mg17Al12)是一种潜在的贮氢材料,该金属互化物在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al。得到的混合物在6.0 mol·L-1 HCl中,能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:填空题
(11分)A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
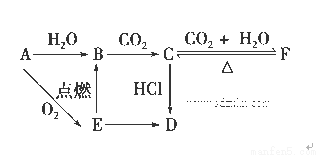
(1)写出A、B、C、D、E、F的化学式:
B.________;C.________;D.________;E.________;
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
E→B: ______________________________________________ _ ,
C→F: ____________________________________________________,
F→C: ____________________________________________________。
(3)下列实验方案中,不能准确测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A. 取a克混合物充分加热,减重b克
B. 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C. 取a克混合物与足量稀硫酸充分反应,逸出气体直接用碱石灰吸收,增重b克
D. 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com