
����Ŀ����ѧ��Ӧԭ����ѧϰ��ѧ����Ҫ��ָ�����á�ijѧϰС���������������̽����
��1��Ӱ�컯ѧƽ���ƶ����ص�̽������NH4Cl ��Һ�д�������ƽ��:NH4Cl + H2O ![]() NH3.H2O + HCl��ijͬѧ�Դ�Ϊ��̽����������Ի�ѧƽ���Ӱ�죬ʵ������¼���£�
NH3.H2O + HCl��ijͬѧ�Դ�Ϊ��̽����������Ի�ѧƽ���Ӱ�죬ʵ������¼���£�
�ı����� | �ʵ������¶� | ��ˮϡ�� | ͨ��HCl��g�� | ������NaOH���� |
ƽ���ƶ����� | ������д | ���� | ���� | ���� |
��д���÷�Ӧ��ƽ�ⳣ������ʽ��____________________________��
����ͬѧ��Ϊ���ϱ������������ı���һ�����оٵ�4��֮�⣬������һ�־�Ϊ����������Ϊ���������һ�����ı���������_____________��
����ѧϰ֮���������������NH4Cl��ˮ��Ӧ�ķ���ʽ��Ӱ��ƽ���ƶ������ط�������ˮϡ�Ͷ�����ƽ���Ӱ��������_____________��
A.ʹ�ô����Ի�ѧƽ���Ӱ�죻 B.��С������Ũ�ȶԻ�ѧƽ���Ӱ�죻
C.�����¶ȶԻ�ѧƽ���Ӱ�죻 D.��Сѹǿ�Ի�ѧƽ���Ӱ��
��2�����ֽⷴӦ���еķ����̽��
��������⡿ΪʲôֻҪ���������ʡ�������ʡ��ӷ����������ɸ��ֽⷴӦ�����ӷ�Ӧ�Ϳ��Է�����
������������⡿С��ͬѧ��һ������˼������������������ʵ���ǻ�ѧ��Ӧ���еķ������⡣�����ϻ�ѧ��Ӧԭ�������֪ʶ���������������������ͣ������������ʡ�������ʡ��ӷ�������ʱ���ᵼ����ϵ��_______________����__________________��
��3����Ӧ���������ʻ�������̽��
��֪I- �ܱ�O2��������I2��Ϊ̽����Ӧ���������ʻ�������������·�����
���� | ���� | |
��һ�� | ��2mL1mol/LKI��Һ�еμӼ��ε�����Һ | δ������ɫ |
�ڶ��� | ��2mL1mol/LKI��Һ�еμ�2mL1mol/LNaOH��Һ�ٵμӼ��ε�����Һ | δ������ɫ |
������ | ��2mL1mol/LKI��Һ�еμ�2mL1mol/LH2SO4��Һ�ٵμӼ��ε�����Һ | ��Һ���� |
������ʵ��֤������ʵ�鲻��ѡ�������Ի����������½��У�Ϊʲô��_____________��
��д��������ʵ���з�����Ӧ�����ӷ���ʽ_____________��
���𰸡� 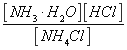 ������NH4Cl���壨������������ɣ� D �ʼ�����H��0�� ��������S>0�� O2�����Ի����������µĻ�ԭ����ΪOH-������I2��Ӧ O2 + 4I- + 4H+ = 2I2 + 2H2O
������NH4Cl���壨������������ɣ� D �ʼ�����H��0�� ��������S>0�� O2�����Ի����������µĻ�ԭ����ΪOH-������I2��Ӧ O2 + 4I- + 4H+ = 2I2 + 2H2O
�������������������1������ƽ�ⳣ���Ķ���дƽ�����ʽ������Ӱ��ˮ��ƽ���ƶ������ط������ۼ�ˮϡ����ͬ�ȱ����ļ�С������Ũ�����������������������Сѹǿ���γɻ�ѧ����������3����OH-����I2��Ӧ���ڵ�����ʵ����I- �ܱ�O2��������I2��
��������1��ˮ�Ǵ�Һ�壬����д��ƽ�ⳣ������ʽ�����Ը÷�Ӧƽ�ⳣ��=![]() ������Ӱ��ˮ��ƽ���ƶ�������������ֻ��ϡ����Һ��ƽ���Ӱ�죬û������Ӧ��Ũ�ȣ������������ı���һ�����оٵ�4��֮���ټ�����NH4Cl���壻�ۼ�ˮϡ����ͬ�ȱ����ļ�С������Ũ�����������������������Сѹǿ����ѡD���γɻ�ѧ������,�������������������������ʡ�������ʡ��ӷ�������ʱ���ᵼ����ϵ����������H��0��������S>0����3����O2�����Ի����������µĻ�ԭ����ΪOH-��OH-����I2��Ӧ����ɵ�����Һ���������ڵ�����ʵ����I- �ܱ�O2��������I2����Ӧ�����ӷ���ʽ��O2 + 4I- + 4H+ = 2I2 + 2H2O��
������Ӱ��ˮ��ƽ���ƶ�������������ֻ��ϡ����Һ��ƽ���Ӱ�죬û������Ӧ��Ũ�ȣ������������ı���һ�����оٵ�4��֮���ټ�����NH4Cl���壻�ۼ�ˮϡ����ͬ�ȱ����ļ�С������Ũ�����������������������Сѹǿ����ѡD���γɻ�ѧ������,�������������������������ʡ�������ʡ��ӷ�������ʱ���ᵼ����ϵ����������H��0��������S>0����3����O2�����Ի����������µĻ�ԭ����ΪOH-��OH-����I2��Ӧ����ɵ�����Һ���������ڵ�����ʵ����I- �ܱ�O2��������I2����Ӧ�����ӷ���ʽ��O2 + 4I- + 4H+ = 2I2 + 2H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ơ��صȽ��������Ż�ʱ���������������ǣ��� ��
A��ˮ B��ú�� C��ɳ�� D����ĭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ũ������ϡ�����˵������ȷ����(����)
A. Ũ����ʹ����ͭ�����ף�������Ũ�������ˮ�� B. Ũ�����������ԣ�ϡ����û��������
C. Ũ���᳣������������������Ӧ D. �����£�Ũ�����ϡ���ᶼ������ͭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ���ǣ� ��
A.��״���£�22.4 Lˮ�к���6.02��1023��ˮ����
B.32 g����������ԭ����ĿΪ2��6.02��1023
C.���³�ѹ�£�0.5��6.02��1023��һ����̼������ռ�������11.2 L
D.1 molCaCl2����ˮ���1 L��Һ��������Һ��Cl�������ʵ���Ũ��Ϊ1 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п������õİ�ͷ����������H�ĺϳ�·������ͼ��ʾ��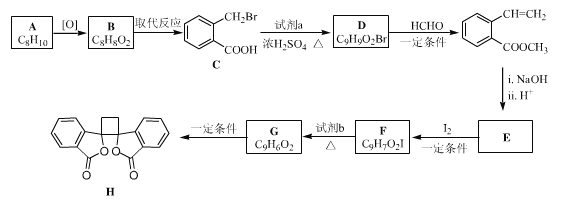
��֪��
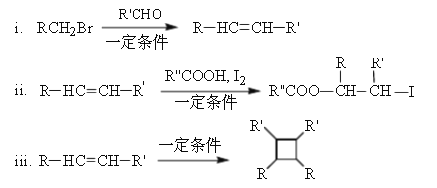
������R��R����R���������⡢�������ȣ�
��1��a���ڷ�������������______________��B����C�ķ�Ӧ������__________��
��2���Լ�a�ǣ�д�ṹ��ʽ��____________��HCHO�ĵ���ʽ��________________��
��3��E�Ľṹ��ʽ��____________��
��4����F����G�Ļ�ѧ����ʽ�� _________��
��5����ȡ�����㻯����W��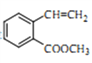 ��ͬ���칹������ʹ������Ȼ�̼��Һ��ɫ���ܠ���������Ӧ���ܷ���ˮ�ⷴӦ��W����_______�֣�����˳���칹�����������칹)�����к˴Ź�������Ϊ�����Ľṹ��ʽΪ___________��
��ͬ���칹������ʹ������Ȼ�̼��Һ��ɫ���ܠ���������Ӧ���ܷ���ˮ�ⷴӦ��W����_______�֣�����˳���칹�����������칹)�����к˴Ź�������Ϊ�����Ľṹ��ʽΪ___________��
��6�����Ҵ�Ϊ��ʼԭ������ϼ�֪��Ϣѡ�ñ�Ҫ�����Լ��ϳ�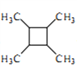 ��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л������ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)��________________
��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л������ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)��________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cl2��70���NaOH��Һ�У���ͬʱ������������������ԭ��Ӧ����Ӧ��ȫ������Һ��NaClO��NaClO3���ʵ���֮��Ϊ4:1����Һ��NaCl��NaClO�����ʵ���֮��Ϊ�� �� ��
A.11:2B.1:1C.9:4D.5:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ��B�Ǻ���ɫ���壬D�Ǻ���ɫ���壬E�dz�������ɫҺ�壬G�ǵ���ɫ��ĩ��
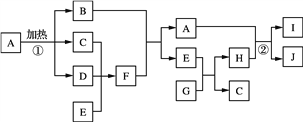
��1��F�Ļ�ѧʽΪ__________��
��2��E�ĵ���ʽΪ__________��
��3��д��E+G��H+C�Ļ�ѧ����ʽ______________��
��4��д����Ӧ�ڵ����ӷ���ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����( )
A. �����ʵ�����������������ֱ���ȫȼ�գ�ǰ�߷ų�������
B. ��C(ʯī)=C(���ʯ) ��H ��+1.90 kJ/mol��֪�����ʯ��ʯī�ȶ�
C. ��101kPaʱ��2g������ȫȼ������Һ̬ˮ���ų�285.8kJ������������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)= 2H2O(l) ��H��-285.8kJ/mol
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ��H>0 ��ӦΪ������Ӧ���κ��¶������Է�����
4NO2(g)+O2(g) ��H>0 ��ӦΪ������Ӧ���κ��¶������Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����X������Yͬʱͨ��ʢ����ҺZ��ϴ��ƿ������ͼ����һ��û�г������ɵ���
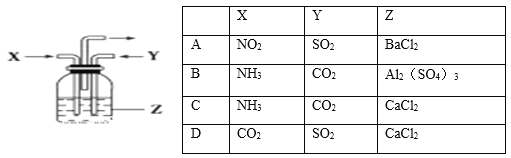
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com