
| A. | 16:9 | B. | 9:11 | C. | 32:9 | D. | 46:9 |
科目:高中化学 来源: 题型:解答题
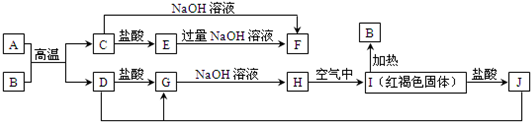
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4L任意比的氢气和二氧化碳的混合气体中含有的分子总数均为NA | |
| B. | 0.1mol/LNaCl溶液中Na+的数目为0.1NA | |
| C. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| D. | 500mL0.2mol/L饱和FeCl3溶液完全转化可制得0.1NA个Fe(OH)3胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是氧化物 | B. | 它含有3种元素 | ||
| C. | 它的摩尔质量是44 g/mol | D. | 1 mol C2H4O含有2NA个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolNa与足量的02反应生成Na20和Na2O2,失去的电子数为NA | |
| B. | 标准状况下,44.8LHF所含分子数为2NA | |
| C. | 在碳酸钠溶液中,若c(C032-)=lmol•L-1,则c(Na+)=2mol•L-l | |
| D. | 已知2SO2(g)+02(g)?2SO3(g);△H=-akJ.mol-l将2NA个SO2与NA个02混合充分反应放出akJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mo1•L-1的NaAlO2 水溶液中含有的氧原子数为2 NA | |
| B. | 含有NA个原子的氢气在标准状况下的体积约为22.4 L | |
| C. | 标准状况下,2.24 LCl2与足量水反应转移的电子数为0.2NA | |
| D. | V L a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ④⑤⑥ | C. | ②③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 1mol氧气约含6.02×1023个O2 | |
| D. | 0.5molH2O含有的原子数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com