
| ||
| 2min |
| 1 |
| 3 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2013?�ֶ�������ģ��һ���¶��£���2L�ܱ������з������з�Ӧ��4NO2��g��+O2��g��?2N2O5��g������֪�÷�Ӧ��ƽ�ⳣ����k300����k350��������ϵ��n��NO2������λ��mol����ʱ��仯���±���
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
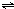 ClO��g��+3H2��g����H��0��
ClO��g��+3H2��g����H��0�� CH3OH��g����H=-90.1kJ?mol-1�����������´�ƽ�⣬���д�ʩ����ʹn��CH3OH��/n��CO���������
CH3OH��g����H=-90.1kJ?mol-1�����������´�ƽ�⣬���д�ʩ����ʹn��CH3OH��/n��CO���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij�����£���2L�ܱ������з������·�Ӧ2NO2��g��?2NO��g��+O2��g��
ij�����£���2L�ܱ������з������·�Ӧ2NO2��g��?2NO��g��+O2��g��| c(NO)2��c(O2) |
| c(NO2)2 |
| c(NO)2��c(O2) |
| c(NO2)2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
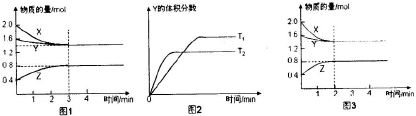
| A����Ӧ���е�ǰ3min�ڣ���X��ʾ�ķ�Ӧ����V��X��=0.1mol/��L?min�� | B��ƽ��ʱ�����ڵ�ѹǿΪ��Ӧǰ��0.8�� | C�����������������䣬�����¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K��С | D�����ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı������������ѹǿ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com